[Ciencias de Joseleg] [Química] [La materia] [El
átomo químico] [Ejercicios
resueltos] [Introducción] [Generalidades] [El
atomismo filosófico] [Introducción
a las leyes ponderales] [Ley
de la conservación de la masa] [Ley
de las proporciones definidas] [Ley
de las proporciones recíprocas] [Ley
de las proporciones múltiples] [Teoría
atómica de Dalton] [Postulado
de composición] [Postulado
de identidad atómica] [Postulado
de identidad molecular] [Postulado
de asociación] [Postulado
de la ecuación química] [Pesos
atómicos] [La
hipótesis de Avogadro] [La
técnica de Cannizzaro] [Del
molécula-gramo al mol] [Del
mol a la cantidad de sustancia] [Historia
de la teoría cinética] [Modelo
matemático de la teoría cinética] [Estequiometría
de composición] [Ley
de Dulong y Petit] [Referencias]
El hecho de que hallamos terminado de exponer los principios
de la teoría atómica de Dalton, no significa que su modelo hubiera quedado
entre comillas perfecto, aún quedaban ciertos problemas en los cuales la
química de gases fue fundamental para poder corregir la hipótesis atómica, y
convertirla en una ruta de investigación válida. Tenga en cuenta que Avogadro
es mejor conocido por su ley moles a volumen:
Expresión que de hecho el jamás postuló realmente, ya que la
magnitud cantidad de sustancia solo fue confirmada hasta la década de 1970. En realidad,
su importancia radica en dos hipótesis diferentes, la hipótesis volumen a
número de moléculas y la hipótesis de los gases diatómicos.
Volúmenes de combinación
En 1808, Joseph Louis Gay-Lussac (1778-1850), al realizar el
experimento Cavendish de formación de agua, observó que los volúmenes de
hidrógeno y oxígeno se combinaron en una proporción de 2:1, con un error
experimental de menos del 0.1%. Además de esto, cuando realizó diferentes
experimentos con otros gases, notó que el volumen del producto resultante en la
reacción, que en el caso del agua era vapor o gas a la temperatura
experimental, estaba relacionado con los volúmenes de los elementos reactivos
en una proporción simple:
De esta manera, llegó a la siguiente conclusión: ‘‘Me parece que
los gases siempre se combinan en las proporciones más simples cuando actúan
entre sí".
Dalton no aceptó los resultados de Gay-Lussac, porque no se
obtuvieron números enteros en esos experimentos de volúmenes de combinación.
Esto se debe a que la hipótesis de Dalton para la descomposición no explicaba
la razón por la cual solo se consumía medio volumen equivalente de oxígeno, los
volúmenes equivalentes deberían ser 1:1. Dado lo anterior podemos indicar que
la ley de Gay-Lussac de volúmenes de combinación también adquiere una forma de
radio de volúmenes.
Donde el cociente de volúmenes será constante siempre y
cuando las condiciones de presión y volumen sea constantes, y que los dos
volúmenes estén vinculados en una misma reacción de síntesis o descomposición.
La hipótesis molécula a volumen
Si ponemos el hallazgo de Gay-Lussac en matemáticas, esto
implica que el volumen de un gas es una propiedad que depende solo del número
de partículas libres que pueden ser átomos o moléculas, pero no de la identidad
de estos.
Por lo que dos números de átomos de elementos distintos
ocuparían el mismo volumen. Fue en 1811, que Amedeo Avogadro (1778-1856)
formuló precisamente esta idea. ‘‘En las mismas condiciones de temperatura y presión,
volúmenes iguales de diferentes gases tienen el mismo número de moléculas”.
Tenga en cuenta que muchas de las leyes naturales que usamos en la parte
numérica no fueron enunciadas originalmente como ecuaciones, o incluso, las
ecuaciones originales pueden ser indistinguibles de sus formas modernas. En
aras de un uso práctico de las leyes naturales hemos estado usando y
continuaremos usando lenguaje moderno. La Ecuación 16.4
tradicionalmente se denomina la hipótesis de Avogadro, pero actualmente debería
recibir el nombre de la ley molecular de Avogadro para volúmenes. Esta ecuación
puede usarse para calcular el volumen que ocupa una sola molécula vibrando como
en el siguiente ejemplo.
Ejemplo. Si tenemos un volumen de gas hidrógeno de
22.4 L que contienen 6.022 x 1023 moléculas en condiciones estándar
de presión y temperatura, determinar el volumen que ocupa una sola molécula de
hidrógeno en condiciones estándar de presión y temperatura.
Dado que el volumen de partículas es literalmente una
constante, cualquier molécula ocupará 3.72x10-2 zeptolitros. Sin
embargo, igual que en otros cálculos que hemos hecho, en época de Avogadro este
tipo de cálculos sería imposible ya que no les era posible contar el número de
átomos en un determinado volumen a presión y temperatura constantes.
El radio estequiométrico
Tradicionalmente se nos dice que el radio estequiométrico es
una cantidad óptima en proporción de una sustancia en una reacción química. En
la práctica el radio estequiométrico es el cociente que ocurre entre dos números
estequiométricos para sustancias diferentes, que normalmente llamaremos la
incógnita (i) y el dato (d) o sustancia 1 y sustancia 2. Normalmente este
cociente no tiene un símbolo propio, pero (Kulikovsky, 2004) propuso emplear la letra delta:
Si tomamos la ecuación que vincula el
número de moléculas con el número de eventos de reacción Nj =
vj Nξ y sacamos un cociente para una
segunda sustancia dentro de la misma reacción entonces el parámetro de número
de eventos de reacción será constante, por lo tanto:
Ejemplo: Si las esferas rojas son A y las esferas
negras B, indique el número de moléculas, el número estequiométrico y el radio
estequiométrico empleando la siguiente figura.
O interesante es que si obtenemos un cociente para la
hipótesis de Avogadro.
Podremos expresar los números estequiométricos en términos
de los volúmenes de combinación ajustados a números enteros pequeños.
La hipótesis de los gases diatómicos
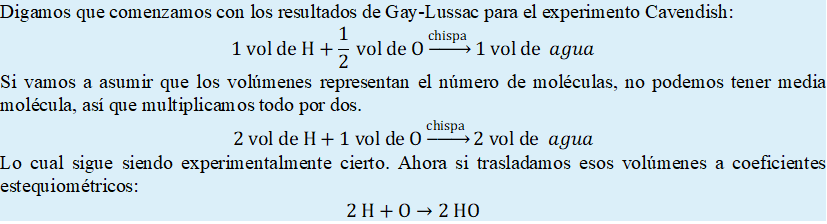
Solo había un pequeño problema con esto, al aplicar los
volúmenes de combinación como coeficientes a las fórmulas moleculares de Dalton
para el agua, se incumplía la ley de la conservación de la masa.
Figura 16‑1. Incumplimiento aparente de la ley de
conservación de la masa en la ecuación química de Dalton para la síntesis de
agua.
Si evaluamos el número de hidrógenos hay dos a ambos lados,
pero si evaluamos el número de oxígenos, la cosa ya no funciona pues tenemos un
oxígeno de un lado y dos del otro. Lo anterior implica que hay algo malo, pues
la ley de la conservación de la masa es una ley que es muy difícil de romper.
Así que solo hay dos cosas que pueden estar mal:
👉 Que el modelo
matemático que llevamos hasta el momento sea solo una fumada mental, y por ende
hemos perdido el tiempo desde la lección de teoría atómica.
👉
Que las fórmulas químicas para las sustancias estén mal, lo cual es más fácil
de corregir.
Avogadro eligió la ruta fácil, así que, en lugar de
reevaluar todas las hipótesis de la teoría atómica, se decantó por modificar
los subíndices del hidrógeno, el oxígeno y el agua, hasta que concordaran
simultáneamente con la ley de la conservación de la masa y los volúmenes de
combinación de Gay-Lussac. El proceso debe haber sido manual, así que para
ahorrarnos tiempo solo expondremos el resultado correcto.
Figura 16‑2. Representación de un evento de reacción molecular
para la síntesis del agua, note que los números estequiométricos indican
cuantas moléculas están presentes, mientras que los subíndices indican cuantos
átomos están pegados en una molécula. En la imagen podemos ver que hay 4 átomos
de hidrógeno azules a ambos lados de la reacción, y dos átomos de oxígeno a
ambos lados de la reacción.
Esta hipótesis se conoce como la hipótesis de los gases diatómicos
debido a que los elementos que hasta ese momento se pensaba eran átomos libres
como hidrógeno, oxígeno, flúor, cloro entre otros, en realidad se comportaban
como moléculas compuestas por dos átomos, siendo el segundo gran aporte de
Avogadro a la teoría atómica. Cuando se aplicaron las hipótesis de gases
diatómicos a otras reacciones de gases, se dieron cuenta que tanto la ley de la
conservación del número de átomos como la ley de volúmenes de combinación de
Gay-Lussac se cumplía. Esto también implica que las primeras ecuaciones
químicas se balancearon primero constando con los volúmenes experimentales, y
la hipótesis de gases de combinación para poder hipotetizar la fórmula
molecular de algunas sustancias, por ejemplo.
Ejemplo: Modele una ecuación química que cumpla con
la ley de la conservación de la masa y la ley de volúmenes de combinación
apoyándose en la hipótesis de gases diatómicos con los siguientes resultados experimentales.
1 L gas nitrógeno+3 L de gas hidrógeno→2 L amoníaco.
Observe que el balanceo de ecuaciones químicas hecho
originalmente se realizaba con los coeficientes estequiométricos conocidos, y
una hipótesis para la fórmula de los elementos gaseosos, y con esto se infería
hipotéticamente la fórmula de los compuestos. Matemáticamente esto fue
extremadamente armonioso y permitió hacer cálculos predictivos, pero los
fundamentos de los cuales emergían, como la existencia de átomos, y que los
elementos fueran moléculas diatómicas no lo fue, se trataba a la vista de
muchos atomistas tibios o antiatomistas como una ficción útil. Los que, si se
creyeron que los fundamentos que sostenían a estas ecuaciones útiles debían
tener algo de verdadero, empezaron a usar estas fórmulas químicas hipotéticas
para empezar a dar nombres sistemáticos a las sustancias, y desligarse
definitivamente de nombres arcaicos heredados de la alquimia como el azote o el
aceite de vitriolo.
Ejemplo. Cuantos
átomos de calcio nitrógeno y oxigeno hay en un mol de Ca(NO3)2







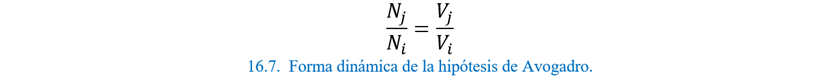


No hay comentarios:
Publicar un comentario