[Ciencias de Joseleg]
[Química]
[La
materia] [Química
de gases] [Ejercicios
resueltos] [Introducción]
[Generalidades]
[Propiedades
de los gases] [Temperatura]
[Volumen]
[Presión]
[Masa
y moles] [Historia]
[La
ley de Boyle] [La
ley de Charles] [La
ley de Gay-Lussac] [Ley
de volúmenes de combinación] [Las
leyes de Avogadro] [Ley
de los gases ideales PV=nRT] [Modificaciones
a PV=nRT] [Ley
de Dalton de presiones] [Estequiometría
de gases] [Concentración
de un gas] [Gases
húmedos] [Ley
de los gases reales] [Ejercicios
especiales] [Referencias
bibliográficas]
Como se mencionó, para medir la presión, la fuerza boyante desviará nuestra medición de la masa de aire, por lo que, para determinar la masa de un gas, primero es importante saber cómo se mide la fuerza boyante, y la clave para esto reside en la bomba de vacío.
Figura 7‑1. Diseño experimental para la estandarización de la fuerza boyante.
A la izquierda se mide una masa estándar en aire y a la derecha se mide la
misma masa en vacío. La diferencia permite calcular la fuerza boyante que luego
puede emplearse para corregir la lectura de las balanzas.
Para pesar un gas con una balanza primero
debes pesar una masa de calibración en aire y luego en vacío, el cual se ha
generado con una bomba de vacío. La diferencia entre las mediciones de masa nos
permite calcular la fuerza boyante, que es constante para una sustancia como el
aire, por lo que ahora podremos usar la lectura de masa en aire, y corregirla
con la medición de la fuerza boyante.
De lo anterior se deduce que la bomba de
vacío fue importante para el desarrollo de la química.
La bomba de vacío
El predecesor de la bomba de vacío fue la
bomba de succión. Se encontraron bombas de succión de doble acción en la ciudad
de Pompeya. El ingeniero árabe Al-Jazari describió más tarde las bombas de
succión de doble acción como parte de las máquinas elevadoras de agua en el
siglo XIII (Safley, 2018). La bomba de succión apareció más tarde en la Europa medieval a
partir del siglo XV (Shapiro, 1964).
Figura 7‑2. Catherine Molchanova estudiante del Instituto Smolny con una
moderna bomba de vacío, por Dmitry Levitzky, 1776
En el siglo XVII, los diseños de bombas de
agua habían mejorado hasta el punto de que producían vacíos medibles, pero esto
no se entendió de inmediato. Lo que se sabía era que las bombas de succión no
podían sacar agua más allá de cierta altura: 18 yardas florentinas según una
medida tomada alrededor de 1635, o unos 34 pies (10 m) (Coulston, 1960). Este límite fue motivo de preocupación en los proyectos de riego,
drenaje de minas y fuentes de agua decorativas planificadas por el duque de
Toscana, por lo que el duque encargó a Galileo Galilei que investigara el
problema. Galileo sugiere incorrectamente en sus Dos nuevas ciencias
(1638) que la columna de una bomba de agua se romperá por su propio peso cuando
el agua se haya elevado a 34 pies (Coulston, 1960). Otros científicos aceptaron el desafío, incluido Gasparo Berti,
quien lo replicó al construir el primer barómetro de agua en Roma en 1639 (Solari, 2019). El barómetro de Berti produjo un vacío sobre la columna de agua,
pero no pudo explicarlo.
El estudiante de Galileo, Evangelista
Torricelli, hizo un gran avance en 1643. Sobre la base de las notas de Galileo,
construyó el primer barómetro de mercurio y escribió un argumento convincente
de que el espacio en la parte superior era un vacío. La altura de la columna se
limitó entonces al peso máximo que la presión atmosférica podía soportar; esta
es la altura límite de una bomba de succión.
En 1650, Otto von Guericke inventó la
primera bomba de vacío (Solari, 2019). Cuatro años más tarde, llevó a cabo su famoso experimento de los
hemisferios de Magdeburg, demostrando que las yuntas de caballos no podían
separar dos hemisferios de los que se había evacuado el aire. Robert Boyle
mejoró el diseño de Guericke y realizó experimentos sobre las propiedades del
vacío. Robert Hooke también ayudó a Boyle a producir una bomba de aire que
ayudó a producir el vacío, por lo que ya desde la época de Boyle era posible
determinar la masa de un gas sin el inconveniente de la fuerza boyante.
Aislamiento de elementos gaseosos
Ahora que se cuenta con la tecnología para
determinar la masa de un gas, el problema recaía en identificar los tipos de
gases, siendo estos puros o mezclas, y medir sus masas. Probablemente los
primeros gases con los que contaban los científicos eran el aire y los vapores
de líquidos volátiles en el vacío, pero para poder avanzar en la historia de la
química debemos pasar de propiedades físicas, a propiedades químicas, y eso
implica tener a nuestra disposición sustancias puras, sean estos elementos como
el oxígeno o compuestos como el dióxido de carbono.
Oxígeno 1604
El oxígeno fue aislado por Michael
Sendivogius antes de 1604, pero comúnmente se cree que el elemento fue
descubierto de forma independiente por Carl Wilhelm Scheele, en Uppsala, en
1773 o antes, y Joseph Priestley en Wiltshire, en 1774. A menudo se da
prioridad a Priestley porque su el trabajo fue publicado primero. Priestley,
sin embargo, llamó al oxígeno "aire desflogistizado" y no lo
reconoció como un elemento químico. El nombre oxígeno fue acuñado en 1777 por
Antoine Lavoisier, quien fue el primero en reconocer el oxígeno como elemento
químico y caracterizó correctamente el papel que desempeña en la combustión (Singh, 2021).
Hidrógeno 1766
El hidrógeno fue descubierto por el físico
inglés Henry Cavendish en 1766. Los científicos habían estado produciendo
hidrógeno durante años antes de que fuera reconocido como un elemento. Los
registros escritos indican que Robert Boyle produjo gas hidrógeno ya en 1671
mientras experimentaba con hierro y ácidos (West, 2014).
Dióxido de carbono
Los primeros científicos pudieron observar
los efectos del dióxido de carbono mucho antes de saber exactamente qué era.
Alrededor de 1630, el científico flamenco Jan van Helmont descubrió que ciertos
vapores diferían del aire, que entonces se pensaba que era una sola sustancia o
elemento.
Joseph Black, un
químico y médico escocés, identificó por primera vez el dióxido de carbono en
la década de 1750. Descubrió que la piedra caliza (carbonato de calcio) podía
calentarse o tratarse con ácidos para producir un gas que llamó "aire fijo".
Observó que el aire fijo era más denso que el aire y no apoyaba al fuego ni a
la vida animal. Black también descubrió que cuando se burbujeaba a través de
agua de cal (una solución acuosa saturada de hidróxido de calcio), precipitaba
carbonato de calcio. Usó este fenómeno para ilustrar que el dióxido de carbono
es producido por la respiración animal y la fermentación microbiana. En 1772,
el químico inglés Joseph Priestley publicó un artículo titulado Impregnating
Water with Fixed Air en el que describía un proceso de goteo de ácido
sulfúrico (o aceite de vitriolo, como Priestley lo conocía) sobre tiza para
producir dióxido de carbono y obligar al gas a evaporarse (Priestley,
1772; Soentgen, 2010).
Gases elementales conocidos en la
época de Avogadro
Para la época de
Avogadro ya se contaba con elementos gaseosos puros como cloro, nitrógeno,
hidrógeno, oxígeno, así como una variedad de gases compuestos, con los cuales
se podían hacer mediciones.
La masa específica y el mol
Con el termómetro, el
manómetro y la bomba de vacío, los químicos pronto se dieron cuenta que un
determinado gas tendría una relación masa-volumen constante si se mantenía la
presión y la temperatura bajo parámetros estables, a este parámetro se lo
conoció como la masa específica de un gas, aunque nosotros la llamamos
actualmente la densidad.
✔ Ejemplo. Tienes un gas con un volumen de 15 cm3 y una masa de 45
g. ¿Cuál es su densidad en g/cm3?
✔ Ejemplo. Una muestra de CO2
tiene una densidad de 2.0 g/cm3. Determine el volumen que ocuparía
si su masa es de 60 g.
De todos los
parámetros de volumen-presión-temperatura posibles, Stanislao Cannizzaro propuso
como valores estándar 22.4 L 0°C y 1 atm de presión, lo cual permitió definir
pesos estándar para los elementos y compuestos gaseosos, lo cual permitió la
aparición de los conceptos de pesos atómicos y moleculares, nombres incorrectos
porque las masas medidas no eran ni de átomos o moléculas, sino de cantidades
visibles de sustancia, por lo que más tarde se lo definió simplemente como el
peso de una mol de sustancia, siendo el mol igual a los 22.4 L a 0°C y 1 atm (Furio, Azcona,
& Guisasola, 2002; Furio, Azcona, Guisasola, & Ratcliffe, 2000; Jensen,
2004).
Cantidad de sustancia y número de
entidades
Posteriormente se
abandonó la conexión entre el mol y las condiciones de gas, y pasó a
convertirse en la unidad del parámetro cantidad de sustancia. La cantidad de
sustancia igual a 1 mol contiene siempre un numero de partículas fijo que
actualmente se denomina como el número de Avogadro (Deslattes,
1980; Güttler, Rienitz, & Pramann, 2019; Perrin, 1911, 1913). De lo anterior podemos análoga el número de
Avogadro como semejante al número par o al número docena, es decir, como un
conjunto de partículas para contar con comodidad. Contar la cantidad de
sustancia es útil ya que permite hacer cálculos sencillos sobre reacciones
químicas con información teórica de proporciones, en lugar de emplear
proporciones experimentales.
Relación masa y cantidad de sustancia
El hecho de que las partículas de gas se
expandan no implica que no posean una masa y pesen. Una pipeta de gas propano
llena es bastante masiva, esto se debe precisamente a que el gas posee masa, y
por lo tanto cuando es afectado por la aceleración gravitacional del planeta
también posee un peso asociado. Las unidades de medida de la masa de un gas
pueden ser específicas, en cuyo caso empleamos el mol, o inespecíficas, en cuyo
caso empleamos gramos u otras unidades no específicas que ya trabajamos en la
unidad de estequiometria y disoluciones.
La
variable cantidad de sustancia (ni)
tiene como unidad el mol y sus modificaciones.
La
variable masa de sustancia: (mi)
tiene como unidad el kilogramo y sus modificaciones.
Las masas de los gases están vinculadas a
reacciones químicas, por lo que una reacción que consuma una sustancia gaseosa
disminuirá la masa del gas, mientras que una reacción que produce una sustancia
gaseosa aumentará la masa del gas y por consiguiente todas las variables
vinculadas a la masa del gas.
El problema con la masa molar “también
llamado peso fórmula o peso de la fórmula, peso molecular o masa de la fórmula
molecular” Mi es que al
estar definida por moles de sustancia si es específica para el tipo de
sustancia, para los átomos individuales los valores se sacan de la tabla
periódica dado que el peso atómico y la masa molar tienen los mismos valores
aunque diferentes unidades (Mi),
y para moléculas (M(AaBb…Zz))
hay que hacer una suma ponderada.
El término de ponderación es el subíndice
(siI) que representa la
cantidad de veces que se repite un elemento en una molécula.
La unidad de la masa molar es gramos en
cada mol de sustancia “g / mol” y dependerá de la cantidad de veces que se
repite un átomo en la formula molecular y del peso atómico expresado en la
tabla periódica.
✔
Ejemplo. Como calcular la masa molar de Cl2,
S8, P4 a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de He, H2, N2 y O2 a
cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de Cl2, S8, P4 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar de H2O a cuatro cifras
significativas
✔ Ejemplo. Como calcular la masa molar
de CO2 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de H3PO4 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de NaOH y Ca(OH)2 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de NO2 a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de C6H12O6 a cuatro
cifras significativas
✔
Ejemplo. Como calcular la masa molar de Na3PO4 a
cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de C3H8 a cuatro cifras
significativas
✔ Ejemplo. Como calcular la masa molar
de MnCl2 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de KClO3 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de (NH4)2SO4 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de CaCO3 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de NH3 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de CuSO4 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de C2H5OH a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de CuSO4·5H2O a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de NH4NO2 a cuatro cifras significativas
✔
Ejemplo. Como calcular la masa molar
de Al(OH)3 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de Li2CO3 a cuatro cifras significativas
✔
Ejemplo. Como calcular la masa molar de K2Cr2O7
a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de KMnO4 a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de metanol CH3OH a cuatro cifras
significativas
✔
Ejemplo. Como
calcular la masa molar de HNO2 a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de Na2O a cuatro cifras
significativas
✔ Ejemplo. Como calcular la masa molar
de Ca(NO3)2 a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de Fe2O3 a cuatro cifras
significativas
✔
Ejemplo. Como
calcular la masa molar de NaI y NaCl a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de NaClO y KOH a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de Al2(SO4)3 a cuatro
cifras significativas
✔
Ejemplo. Como
calcular la masa molar de C9H10O a cuatro cifras
significativas
✔ Ejemplo. Como
calcular la masa molar de Na2CO3 a cuatro cifras
significativas
✔ Ejemplo. Como calcular la masa molar
de Mg3N2 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de C6H8O6 a cuatro cifras significativas
✔ Ejemplo. Como calcular la masa molar
de (NH4)2HPO4 a cuatro cifras significativas
✔
Ejemplo. Como
calcular la masa molar de H2SO4 a cuatro cifras
significativas
✔ Ejemplo. Como calcular la masa molar
de HNO3 a cuatro cifras significativas.
✔ Ejemplo. Como calcular la masa molar
de NaNO3 a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de KNO3 a cuatro cifras significativas.
✔ Ejemplo. Como calcular la masa molar
de ZnCl2 a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de Na2HPO4 a
cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de HgCl2 a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de (NH4)2Fe(SO4)2
a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de NH4Cl a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de HCN a cuatro cifras significativas.
✔ Ejemplo. Como calcular la masa molar
de MgCl2*6H2O a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de AgNO3 a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de KHCO3 a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de Na2B4O7
a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de ZnSO4 a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de AlCl3 a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de Fe(SO4)3*9H2O
a cuatro cifras significativas.
✔ Ejemplo. Como calcular la masa molar
de Cu(NO3)2*6H2O a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de CH3COOH a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de NiCl2 a cuatro cifras
significativas.
✔
Ejemplo. Como calcular la masa molar de KAl(SO4)2*12H2O
a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de C6H6O a cuatro
cifras significativas.
✔
Ejemplo. Como calcular la masa molar de C4H10O3
a cuatro cifras significativas.
✔
Ejemplo. Como calcular la masa molar de Fe2(SO4)3
a cuatro cifras significativas.
Una vez que tienes la masa molar puedes
calcular los moles o los gramos de un a sustancia manipulando adecuadamente la
definición de masa molar M = m / n.
✔ Ejemplo. ¿Cuantos
moles hay en 90 g de H2?
✔ Ejemplo. ¿Cuantos
moles hay en 4.0 g de N2?
Concentración molar de un gas (c)
En química, la concentración es la
abundancia de un componente dividido por el volumen total de una mezcla. Se
pueden distinguir varios tipos de descripción matemática: concentración de
masa, concentración molar, concentración de números y concentración de volumen.
Una concentración puede ser cualquier tipo de mezcla química, pero con mayor
frecuencia solutos y disolventes en soluciones. La concentración molar
(cantidad) tiene variantes como la concentración normal y la concentración
osmótica.
Para los gases hay dos tipos de medida de
concentración, la primera es la densidad o masa sobre volumen. La segunda es la
concentración de cantidad de sustancia, conocida coloquialmente como la
concentración molar.




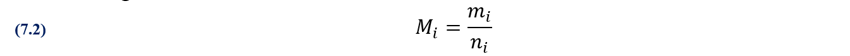


No hay comentarios:
Publicar un comentario