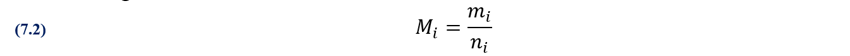[Ciencias de Joseleg]
[Química]
[La
materia] [Química
de gases] [Ejercicios
resueltos] [Introducción]
[Generalidades]
[Propiedades
de los gases] [Temperatura]
[Volumen]
[Presión]
[Masa
y moles] [Historia]
[La
ley de Boyle] [La
ley de Charles] [La
ley de Gay-Lussac] [Ley
de volúmenes de combinación] [Las
leyes de Avogadro] [Ley
de los gases ideales PV=nRT] [Modificaciones
a PV=nRT] [Ley
de Dalton de presiones] [Estequiometría
de gases] [Concentración
de un gas] [Gases
húmedos] [Ley
de los gases reales] [Referencias
bibliográficas]
Al igual que las leyes de Avogadro y otras leyes empíricas de gases, la ley de los gases ideales puede modificarse para estado, identidad de la sustancia, pureza, masa, densidad, y número de entidades, así como ser adaptada para sistemas no gaseosos, pero que se describen como ideales por comportarse de manera tal que pueden operarse como si fueran gases.
Formas dinámicas
Al igual que con la ley de Avogadro, la
ecuación de estado estático puede modificarse, ya sea para un cambio de estado
o para un cambio de identidad de gas, ya sea dos gases mezclados, o un gas al
interior de un conjunto total o mezcla de gases.
🔎 DEMOSTRACION. Demostrar las
modificaciones que tiene la ley de los gases ideales para cambio de estado,
cambio de identidad y mezcla de gases.
De las formas dinámicas más comunes, tenemos la forma P V T, que
ocurre en un cambio de estado a volumen constante.
🔎 DEMOSTRACION. Demostrar la ecuación de estado de los gases ideales para un cambio
de estado asumiendo que la masa o cantidad de sustancia del gas permanece
constante.
Matamala
y González
✔ Ejercicio
7.5. Cierta
masa de gas ocupa 20 litros a 27 °C y 380 mm de presión ¿Qué volumen ocupará en
C.N.?
Química
de Chang 10
✔ Ejemplo 5.7.
Una pequeña burbuja se eleva desde el fondo
de un lago, donde la temperatura y la presión son 8 °C y 6.4 atm, hasta la
superficie del agua, donde la temperatura es 25 °C y la presión es 1.0 atm.
Calcule el volumen final (en mL) de la burbuja si su volumen inicial fue de 2.1
mL.
✔ Problema-5.35. Un globo lleno de gas, que
tiene un volumen de 2.50 L a 1.2 atm y 25°C, se eleva en la estratosfera (unos
30 km sobre la superficie de la Tierra), donde la temperatura y la presión son
de -23°C y 3.00 x 10-3 atm, respectivamente. Calcule el volumen
final del globo.
Química
la ciencia central 13
✔ Práctica
10.06.1. Un gas ocupa un volumen de 0.75 L a 20 °C a
720 torr. ¿Qué volumen ocuparía el gas a 41 °C y 760 torr? (a) 1.45 L, (b) 0.85
L, (c) 0.76 L, (d) 0.66 L, (e) 0.35 L.
✔ Ejercicio 10.43c. El cloro se usa
ampliamente para purificar los suministros municipales de agua y para tratar
las aguas de piscinas. Suponga que el volumen de una muestra particular de gas
Cl2 es 8.70 L a 895 torr y 24 °C. (c) ¿A qué temperatura será el
volumen 15,00 L si la presión es 8,76x102 torr?
✔ Práctica 10.06.2. Una muestra de oxígeno gaseoso de 0.50 mol se encuentra confinada a 0 °C y 1.0 atm en un cilindro con un pistón móvil. El pistón comprime el gas de modo que el volumen final es la mitad del volumen inicial y la presión final es de 2.2 atm. ¿Cuál es la temperatura final del gas en grados Celsius?
Hipertexto
✔ Problemas básicos 9. Un gas ocupa un volumen de 520 mL a 25 °C y 650 mmHg de presión. Calcula el volumen que ocuparía el gas a 700 mmHg y 32 °C.
Las condiciones estándar y
variación del volumen molar
Las condiciones estándar para la
temperatura y la presión son conjuntos estándar de condiciones para que se
establezcan mediciones experimentales que permitan realizar comparaciones entre
diferentes conjuntos de datos. Los estándares más utilizados son los de la
Unión Internacional de Química Pura y Aplicada (IUPAC) y el Instituto Nacional
de Estándares y Tecnología (NIST), aunque estos no son estándares
universalmente aceptados. Otras organizaciones han establecido una variedad de
definiciones alternativas para sus condiciones de referencia estándar. En
química, IUPAC cambió la definición de temperatura y presión estándar (STP) en
1982:
👉 Hasta
1982, el STP se definió como una temperatura de 273.15 K (0 ° C, 32 ° F) y una presión
absoluta de exactamente 1 atm (101.325 kPa).
👉 Desde
1982, STP se define como una temperatura de 273.15 K (0 ° C, 32 ° F) y una
presión absoluta de exactamente 105 Pa (100 kPa, 1 bar). Aunque la presión
cambia un poco, en la práctica se puede redondear a 1 atm con un error de
aproximación de poco más del 1%.
El volumen que calculamos anteriormente se
denomina formalmente como volumen molar, ya que es el volumen que ocupa una mol
de sustancia en condiciones estándar. El resultado con calculadora es de 22.4 L
/ mol.
🔎 DEMOSTRACION. Demostrar una función que permita calcular el volumen molar de un
gas para cualquier condición de temperatura y presión.
Matamala
y González
✔ Ejercicio
7.19. El volumen molar del
acetileno, C2H2, a 300 K y 0,45 atm, es:
Química la ciencia central 11
✔ Ejercicio 10.29. (a) ¿Qué condiciones representa la abreviatura STP? (b) ¿Cuál es el volumen molar de un gas ideal en STP? (c) A menudo se supone que la temperatura ambiente es de 25 ° C. Calcule el volumen molar de un gas ideal a 25 ° C y 1 atm de presión. (d) Si mide la presión en bares en lugar de atmósferas, calcule el valor correspondiente de R en L-bar / mol-K.
Modificaciones de la ley de los gases ideales
A parte de las formas dinámicas, la ecuación
de estado posee otras modificaciones importantes a saber.
Ecuación de estado en términos de la masa (Estequiometría
de gases)
|
Diferentes formas de la ecuación de Estado
de los gases ideales que emplea la masa en lugar de la cantidad de sustancia.
|
|
Matamala
y González
✔ Ejercicio
7.12. ¿Cuál
es el peso molecular de un gas de 1 g, si el mismo ocupa 200 ml a 150°C y 760
mmHg?
✔ Ejercicio
7.14. Hallar el peso molecular de un gas, si 725 ml
del mismo, a 20°C y 562 mmHg, pesan 0,983 g.
✔ Ejercicio 7.16. ¿Cuánto pesan 0,75 L de
cloro, Cl2, medidos a 20°C y 0,25 atm de presión?
Química
de Chang 10
✔ Ejemplo 5.9. Un químico ha sintetizado
un compuesto gaseoso de color amarillo verdoso de cloro y oxígeno y encuentra
que su densidad es de 7.71 g / L a 36°C y 2.88 atm. Calcule la masa molar del
compuesto y determine su fórmula molecular.
✔ Práctica 5.9. La densidad de un compuesto
orgánico gaseoso es 3.38 g / L a 40°C y 1.97 atm. ¿Cuál es su masa molar?
Química
la ciencia central 13
✔ Ejercicio 10.31. Suponga que le dan dos matraces de 1 L y le
dicen que uno contiene un gas de masa molar 30, el otro un gas de masa molar
60, ambos a la misma temperatura. La presión en el matraz A es X atm, y la masa
de gas en el matraz es 1.2 g. La presión en el matraz B es 0.5 X atm, y la masa
de gas en ese matraz es 1.2 g. ¿Qué matraz contiene el gas de la masa molar 30
y cuál contiene el gas de la masa molar 60?
✔ Ejercicio 10.32. Suponga que le dan dos matraces a la misma
temperatura, uno de volumen 2 L y el otro de volumen 3 L. El matraz de 2 L
contiene 4,8 g de gas y la presión del gas es X atm. El matraz de 3 litros
contiene 0,36 g de gas, y la presión del gas es 0,1X. ¿Los dos gases tienen la
misma masa molar? Si no, ¿cuál contiene el gas de mayor masa molar?
✔ Ejercicio 10.35. Los dirigibles Goodyear, que con frecuencia
vuelan sobre eventos deportivos, contienen aproximadamente 175000 pies3
de helio. Si el gas está a 23 °C y 1.0 atm, ¿qué masa de helio hay en un
dirigible?
✔ Ejercicio 10.39a. El tanque de un buzo contiene 0.29 kg de O2
comprimido en un volumen de 2.3 L. Calcule la presión de gas dentro del tanque
a 9 °C.
✔ Ejercicio 10.39b. El tanque de un buzo contiene 0.29 kg de O2
comprimido en un volumen de 2.3 L. ¿Qué volumen ocuparía 0.29 kg de O2
a 26 °C y 0.95 atm?
✔ Ejercicio 10.40a. Una lata de aerosol con un volumen de 250 ml
contiene 2.30 g de gas propano C3H8 como propulsor. Si la
lata está a 23 °C, ¿cuál es la presión en la lata?
✔ Ejercicio 10.40c. Una lata de aerosol con un volumen de 250 ml
contiene 2.30 g de gas propano C3H8 como propulsor. La
etiqueta de la lata dice que la exposición a temperaturas superiores a 130 °F
puede hacer que la lata explote. ¿Cuál es la presión en la lata a esta
temperatura?
✔ Ejercicio 10.43a. El cloro se usa ampliamente para purificar
los suministros municipales de agua y para tratar las aguas de piscinas.
Suponga que el volumen de una muestra particular de gas Cl2 es 8.70
L a 895 torr y 24 ° C. ¿Cuántos gramos de Cl2 hay en la muestra?
✔ Ejercicio 10.51b. Calcule
la masa molar de un gas si 2,50 g ocupa 0,875 L a 685 torr y 35 ° C.
✔ Ejercicio 10.52b. Calcule la masa molar de un vapor que tiene
una densidad de 7,135 g/L a 12 ° C y 743 torr.
✔ Ejercicio 10.53. En la técnica del bulbo de
Dumas para determinar la masa molar de un líquido desconocido, se vaporiza la muestra
de un líquido que hierve por debajo de 100 ° C en un baño de agua hirviendo y
se determina la masa de vapor necesaria para llenar el bulbo. A partir de los
siguientes datos, calcule la masa molar del líquido desconocido: masa de vapor
desconocido, 1,012 g; volumen de bulbo, 354 cm3; presión, 742 torr;
temperatura, 99 ° C.
✔ Ejercicio 10.54. La masa molar de una sustancia volátil se
determinó mediante el método del bulbo de Dumas descrito en el ejercicio 10.53.
El vapor desconocido tenía una masa de 0,846 g; el volumen del bulbo era de 354
cm3, la presión de 752 torr y la temperatura de 100 °C. Calcule la
masa molar del vapor desconocido.
✔ Ejercicio 10.74a. Una muestra de 3.00 g de SO2(g)
originalmente en un recipiente de 5.00 L a 21 °C se transfiere a un recipiente
de 10.0 L a 26 °C. Una muestra de 2.35 g de N2(g) originalmente en
un recipiente de 2.50 L a 20 °C se transfiere a este mismo recipiente de 10.0
L. ¿Cuál es la presión parcial de SO2(g) en el recipiente más
grande?
✔ Ejercicio 10.74b. Una muestra de 3.00 g de SO2(g) originalmente en un recipiente de 5.00 L a 21 °C se transfiere a un recipiente de 10.0 L a 26 °C. Una muestra de 2.35 g de N2(g) originalmente en un recipiente de 2.50 L a 20 °C se transfiere a este mismo recipiente de 10.0 L. (b) ¿Cuál es la presión parcial de N2(g) en este recipiente?
Hipertexto
✔ Problemas de profundización 12. Calcula el volumen de un tanque de 40 kg de
metano (CH4) a 25 °C y 1 atm. ¿Qué sucederá si se aumenta la
temperatura y la presión?
Ecuación de estado en términos de la densidad
🔎
DEMOSTRACION. Hallar
la forma de la ecuación de estado P V = n R T que permite usar la densidad,
para sus formas estática y dinámica.
Matamala y Gonzalez
✔ Ejercicio 7.15. Hallar la densidad del
amoníaco, NH3, a 640 mmHg y 27°C.
Química de Chang 10
✔ Ejemplo 5.8. Calcule la densidad del dióxido
de carbono (CO2) en gramos por litro (g / L) a 0.990 atm y 55°C.
✔ Práctica 5.8. ¿Cuál es la
densidad (en g / L) del hexafluoruro de uranio (UF6) a 779 mmHg y
62ºC?
✔ Problema-5.48.
Calcule
la densidad del gas bromuro de hidrógeno (HBr) en gramos por litro a 733 mmHg y
46 °C.
Química la ciencia central 13
✔ Muestra 10.07.
¿Cuál
es la densidad del vapor de tetracloruro de carbono a 714 torr y 125 °C?
✔ Práctica
10.07.1. ¿Cuál es la densidad del metano, CH4,
en un recipiente donde la presión es de 910 torr y la temperatura es de 255 K?
(a) 0.92 g/L, (b) 697 g/L, (c) 0.057 g/L, (d) 16 g/L, (e) 0.72 g/L.
✔ Práctica
10.07.2. La masa molar media de la atmósfera en la
superficie de Titán, la luna más grande de Saturno, es de 28.6 g/mol. La
temperatura de la superficie es de 95 K y la presión es de 1.6 atm. Suponiendo
un comportamiento ideal, calcule la densidad de la atmósfera de Titán.
✔ Práctica
10.08.2. Calcula la masa molar promedio del aire seco
si tiene una densidad de 1.17 g/L a 21 °C y 740.0 torr.
✔ Ejercicio 10.47. ¿Qué gas es más denso a
1,00 atm y 298 K: CO2, N2O o Cl2? Explique.
✔ Ejercicio 10.48. Clasifique
los siguientes gases del menos denso al más denso a 1,00 atm y 298 K: SO2,
HBr, CO2. Explique.
✔ Ejercicio 10.51a. Calcule la densidad del gas NO2 a
0,970 atm y 35 °C.
✔ Ejercicio 10.52a. Calcule la densidad del gas hexafluoruro de azufre a 707 torr y 21 °C.
Hipertexto
✔ Problemas básicos 8.3. Determinar el peso molecular de un gas cuya
densidad es 1.62 g/L a 200 K y 1.89 atmósferas de presión
Ecuación de estado en términos del número de entidades y
la constante de Boltzman
🔎 DEMOSTRACION. Hallar la forma de la
ecuación de estado P V = n R T que permite usar el número de moléculas o átomos
de un gas, para sus formas estática y
dinámica.
Matamala
y González
✔ Ejercicio 7.25. En un tubo de 820 ml con
gas enrarecido, la presión es de 1,9x10-6 mmHg. Si la temperatura es
de 0°C, ¿Cuántas moléculas de gas hay en el tubo?
Química
de Chang 10
Química
la ciencia central 13
✔ Ejercicio 10.37a. Calcule
el número de moléculas en una respiración profunda de aire cuyo volumen es 2.25
L a temperatura corporal, 37 °C y una presión de 735 torr.
Ecuación de estado en términos de la concentración molar
Propiedades coligativas de Henry y de Raoult
Dos de las cuatro propiedades coligativas
se pueden derivar de la ley de los gases ideales, mediante el presunto de que
una solución líquida lo suficientemente diluida (con una concentración muy,
pero muy baja) se comporta como una mezcla de gases ideales. Por ende, podemos
modelar el comportamiento de sustancias líquidas con el modelo de un gas, a
este tipo de disoluciones se las denomina en consecuencia, disoluciones
ideales.
🔎
DEMOSTRACION. Deduzca
las leyes de Henry y Raoult a partir de la ecuación de estado de los gases
ideales.
Otra consecuencia de tener disoluciones ideales
es que el cociente de la mayoría de las unidades de concentración es
significativamente semejante, cuestión que demostraremos en el capítulo de
propiedades coligativas. Lo importante de este detalle es que podemos tomar la
forma dinámica de la ley de Henry, y reemplazar el cociente de concentraciones
molares, por el cociente de fracciones molares, y cambiar la identidad de la
sustancia por el solvente. Finalmente, si asumimos que la fracción molar
inicial del solvente representa la del solvente puro, podemos cancelarla porque
sabemos que la fracción molar de cualquier sustancia pura vale 1. La ley
resultante recibe el nombre de ley de Raoult.