[Ciencias de Joseleg]
[Química]
[La
materia] [Química
de gases] [Ejercicios
resueltos] [Introducción]
[Generalidades]
[Propiedades
de los gases] [Temperatura]
[Volumen]
[Presión]
[Masa
y moles] [Historia]
[La
ley de Boyle] [La
ley de Charles] [La
ley de Gay-Lussac] [Ley
de volúmenes de combinación] [Las
leyes de Avogadro] [Ley
de los gases ideales PV=nRT] [Modificaciones
a PV=nRT] [Ley
de Dalton de presiones] [Estequiometría
de gases] [Concentración
de un gas] [Gases
húmedos] [Ley
de los gases reales] [Ejercicios
especiales] [Referencias
bibliográficas]
En química y física, la ley de Dalton
(también llamada ley de presiones parciales) establece que, en una mezcla de
gases no reactivos, la presión total ejercida es igual a la suma de las
presiones parciales de los gases individuales. Esta ley empírica fue observada
por John Dalton en 1801 y publicada en 1802. La ley de Dalton está relacionada
con las leyes del gas ideal, especialmente con la cantidad de sustancia y la
fracción molar.
Figura 16‑1. John Dalton
(6 de septiembre de 1766 - 27 de julio de 1844) fue un químico, físico y
meteorólogo inglés. Es mejor conocido por introducir la teoría atómica en la
química y por su investigación sobre la ceguera al color, a veces denominado
Daltonismo en su honor.
Dalton derivó la ley de las presiones
parciales de su trabajo sobre la cantidad de vapor de agua que podría ser
absorbido por el aire a diferentes temperaturas. Por lo tanto, es apropiado que
esta ley se use con mayor frecuencia para corregir la cantidad de vapor de agua
recogido cuando se recolecta un gas al desplazar el agua.
La Ley de Dalton se aplica principalmente
a los gases ideales en lugar de a los gases reales, debido a la elasticidad y
al bajo volumen de partículas de las moléculas en los gases ideales. El químico
Humphry Davy se mostró escéptico sobre la Ley de Dalton, hasta que Dalton
explicó que las fuerzas repelentes que antes se creían que creaban presión solo
actuaban entre átomos del mismo tipo, y que los átomos dentro de una mezcla
variaban en peso y complejidad.
El principio de la Ley de Dalton se puede
demostrar usando un experimento simple que involucra una botella de vidrio y un
tazón grande de agua. Cuando la botella se sumerge bajo el agua, el agua que
contiene se desplaza, pero la botella no está vacía; se llena con el gas
invisible hidrógeno en su lugar. La cantidad de presión ejercida por el
hidrógeno se puede identificar mediante un cuadro que enumera la presión de los
vapores de agua a diferentes temperaturas, también gracias a los
descubrimientos de Dalton. Este conocimiento tiene muchas aplicaciones
prácticas útiles hoy en día. Por ejemplo, los buceadores utilizan los
principios de Dalton para medir cómo los niveles de presión a diferentes
profundidades del océano afectarán el aire y el nitrógeno en sus tanques.
A principios de 1800, Dalton también
postuló una ley de expansión térmica que ilustraba la reacción de calentamiento
y enfriamiento de los gases a la expansión y compresión. Obtuvo fama
internacional por su estudio adicional utilizando un higrómetro de punto de
rocío toscamente diseñado para determinar cómo la temperatura afecta el nivel
de vapor de agua atmosférico.
Esta ley se sustenta en la idealidad con
la que asumimos a los gases. Dado que asumimos a todos los gases como sin
identidad química, en esencia una suma de
Química
de Chang 10
✔ Problema-5.66.
Se recoge una mezcla de gases de helio y neón
sobre agua a 28.0 °C y 745 mmHg. Si la presión parcial del helio es 368 mmHg,
¿cuál es la presión parcial del neón? (Presión de vapor de agua a 28 °C 5 28.3
mmHg.)
Química
la ciencia central 13
✔ Muestra 10.10.
Una mezcla de 6.00 g de O2(g) y
9.00 g de CH4(g) se coloca en un recipiente de 15.0 L a 0 °C. ¿Cuál
es la presión parcial de cada gas y cuál es la presión total en el recipiente?
✔ Ejercicio 10.64. Un buzo de aguas profundas usa un cilindro
de gas con un volumen de 10.0 L y un contenido de 51.2 g de O2 y 32.6 g de He.
Calcula la presión parcial de cada gas y la presión total si la temperatura del
gas es de 19 °C.
✔ Ejercicio 10.67. Un trozo de hielo seco (dióxido de carbono
sólido) con una masa de 5,50 g se coloca en un recipiente de 10,0 L que ya
contiene aire a 705 torr y 24 °C. Después de que el dióxido de carbono se ha
sublimado por completo, ¿cuál es la presión parcial del gas CO2 resultante y la
presión total en el recipiente a 24 °C?
✔ Ejercicio 10.68. Una muestra de 5.00 mL de éter dietílico (C2H5OC2H5, densidad = 0.7134 g/mL) se introduce en un recipiente de 6.00 L que ya contiene una mezcla de N2 y O2, cuyas presiones parciales son P(N2) = 0.751 atm y P(O2) = 0.208 atm. La temperatura se mantiene a 35.0 °C y el éter dietílico se evapora totalmente. (a) Calcule la presión parcial del éter dietílico. (b) Calcule la presión total en el recipiente.
Esta ley fue establecida en 1801 por John
Dalton, el mismo Dalton de la teoría Atómica (Pickover, 2008). La ley de Dalton
no se sigue de forma tan estricta por los gases reales, y algunas desviaciones
pueden llegar a ser considerablemente altas. La razón de ello es que al
aumentar la presión de un gas real las interacciones moleculares de atracción o
repulsión puede provocar un aumento o disminución del volumen ideal que no
asume interacciones moleculares. A volumen y temperatura constante, la ley de
las presiones parciales de Dalton puede convertirse en la ley de fracciones
molares.
Otras formas aditivas
La ley de Dalton o de presiones aditivas
no es la única forma matemática aditiva que pueden asumir los gases, otras formas
aditivas son, la adición de volúmenes, y la adición de cantidad de sustancia.
El uso de una ley aditiva está condicionado,
por el contexto del ejercicio, y normalmente se usan en combinación con la ley
de los gases ideales que veremos a continuación con mayor profundidad.
Efecto de la ley de Dalton y otras
formas aditivas en la ley de los gases ideales.
Dado
lo anterior deberíamos preguntarnos, cual es el efecto de las leyes aditivas en
la ecuación de los gases ideales.
🔎 DEMOSTRACION. Obtener la ecuación de
estado de los gases ideales en términos de una mezcla de gases donde tenemos
varias (a) presiones (b) cantidades de sustancia (c) masas (d) volúmenes.
Matamala
y González
✔ Ejercicio
7.29. Se
mezclan 16 g de SO2 y 5,5 de CO2 en un recipiente de 5,6
L, a una temperatura de 27°C. Hallar la presión en mmHg.
Química
la ciencia central 13
✔ Práctica 10.10.1. Un cilindro de 15 L
contiene 4.0 g de hidrógeno y 28 g de nitrógeno. Si la temperatura es de 27 °C,
¿cuál es la presión total de la mezcla? (a) 0.44 atm, (b) 1.6 atm, (c) 3.3 atm,
(d) 4.9 atm, (e) 9.8 atm.
✔ Práctica 10.10.2.
¿Cuál
es la presión total ejercida por una mezcla de 2.00 g de H2(g) y
8.00 g de N2(g) a 273 K en un recipiente de 10.0 L?
✔ Ejercicio 10.62b. Considere una mezcla de dos gases, A y B,
confinada en un recipiente cerrado. Se agrega una cantidad de un tercer gas, C,
al mismo recipiente a la misma temperatura. ¿Cómo afecta la adición de gas C a
lo siguiente: la presión total en el recipiente.
✔ Ejercicio 10.74c. Una muestra de 3.00 g de SO2(g)
originalmente en un recipiente de 5.00 L a 21 °C se transfiere a un recipiente
de 10.0 L a 26 °C. Una muestra de 2.35 g de N2(g) originalmente en
un recipiente de 2.50 L a 20 °C se transfiere a este mismo recipiente de 10.0
L. (c) ¿Cuál es la presión total en el recipiente?
Dos gases que se expanden y mezclan
🔎 DEMOSTRACION. Obtener la ecuación que
permite calcular la presión total y cantidad de sustancia total en términos de
dos o más gases en contenedores de tamaño y presión diferente que se mezclan a
temperatura constante.
Si despejáramos el producto presión por
volumen total veremos que la ecuación es semejante a la ley de Boyle, por lo
que podemos bautizarla como la ley Dalton-Boyle, ya que mezcla ambas leyes en
una sola “y molesta” situación.
Química
la ciencia central 13
✔ Ejercicio
10.61c. Considere
el aparato que se muestra en el siguiente dibujo. ¿Cuál es la presión total en
el recipiente después de que se mezclan los gases?
✔ Ejercicio
10.62a. Considere
una mezcla de dos gases, A y B, confinada en un recipiente cerrado. Se agrega
una cantidad de un tercer gas, C, al mismo recipiente a la misma temperatura.
¿Cómo afecta la adición de gas C a lo siguiente: la presión parcial del gas A,


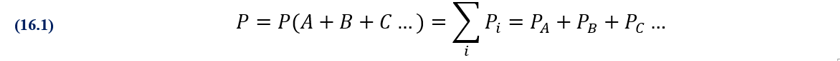



No hay comentarios:
Publicar un comentario