👉Enunciado: Un químico ha sintetizado un compuesto gaseoso de color amarillo verdoso de cloro y oxígeno y encuentra que su densidad es de 7.71 g / L a 36°C y 2.88 atm. Calcule la masa molar del compuesto y determine su fórmula molecular.
|| Mas ejercicios resueltos || Ejercicios de otros capítulos de química || Química de gases || ¡Si te gustó, suscríbete! ||
👉Demostración de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/ley-de-los-gases-ideales.html
👉Solución: Usaremos la variante de la ecuación de estado que usa la densidad, y que podrá encontrar en el enlace anterior, y despejamos la masa molar.
Reemplazamos.
Ahora determinamos los posibles óxidos del cloro, los cuales son cuatro, Cl2O, ClO2, Cl2O3, Cl2O5, Cl2O7. Podemos eliminar a todos los óxidos de dos cloros ya que tendrían masas molares superiores a 71 g/mol, por lo que la única opción viable es el dióxido de cloro. Calculamos la masa molar del dióxido de cloro para corroborar la respuesta.
👉Otros enunciados: Determine la masa molar y la fórmula de un óxido de cloro a 7.71 g / L a 36°C y 2.88 atm, Determinar la masa molar y la fórmula de un óxido de cloro a 7.71 g / L a 36°C y 2.88 atm, Halle la masa molar y la fórmula de un óxido de cloro a 7.71 g / L a 36°C y 2.88 atm, Hallar la masa molar y la fórmula de un óxido de cloro a 7.71 g / L a 36°C y 2.88 atm, Calcule la masa molar y la fórmula de un óxido de cloro a 7.71 g / L a 36°C y 2.88 atm, Calcular la masa molar y la fórmula de un óxido de cloro a 7.71 g / L a 36°C y 2.88 atm,
👉Temas: química, química general, química de gases, leyes de los gases, ecuación de estado, concentración molar de un gas, diferencia entre la molaridad de un gas y una disolución líquida, joseleg


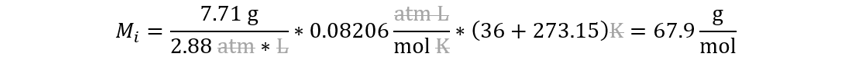

No hay comentarios:
Publicar un comentario