martes, 22 de junio de 2021
6. Otros modelos atómicos clásicos | ⚛️ El átomo físico clásico | Joseleg
[Ciencias de Joseleg] [Química] [La materia] [El
átomo físico clásico] [Ejercicios
resueltos] [Introducción] [La
electricidad y el átomo] [La
constante de Faraday y la electrolisis] [Experimentos
con tubos de rayos catódicos] [Modelo
atómico de Thomson] [Otros
modelos atómicos clásicos] [Modelo
atómico de Rutherford] [Introducción
al núcleo atómico] [Estequiometría
de isótopos] [Referencias]
Los modelos atómicos representados en los libros de texto
presentan un salto entre el modelo atómico de Thomson (1904) y el modelo
atómico de Rutherford (1911), sin embargo, vale la pena aclarar que entre los
dos existieron varios modelos del átomo. Normalmente se dice que la “historia
la escriben los vencedores”. Mientras que esta afirmación generalmente
corresponde a los ganadores de conflictos militares y políticos, se tiene un
efecto similar en la historia de las ciencias. Los libros de texto de física y
química de nivel de secundaria, preparatoria y universitarios generalmente
narran la historia del átomo de forma reducida y consecutiva, una sucesión de
paradigmas, cada uno suplantando al anterior para responder lo que el anterior
decía, junto con la nueva información. Esta historia del libro de texto omite
muchos de los problemas, controversias, ideas erróneas y problemas que tuvieron
los miembros de la comunidad científica para poder plantear, defender o aceptar
un determinado modelo o teoría.
Incluso los científicos más geniales deben enfrentar ideas
erróneas propias antes de dar con una respuesta aceptable para un fenómeno
complejo. Desafortunadamente las historias de los libros de texto hacen pensar
a muchas personas, e incluso a los mismos científicos que la ciencia se trata
de “tener siempre la razón”. Esta actitud puede ser problemática ya que impide
que los investigadores expongan hipótesis válidas por miedo a cometer un
“error”. En esta historia de errores podemos aislar al menos otros 7 modelos
atómicos que fueron planteados de forma concomitante al modelo de Thomson o
antes del modelo de Rutherford.
El modelo planetario de
Perrin (1901)
Figura 6‑1. El
modelo planetario del átomo fue planteado originalmente por Jean Perrin en 1901.
En una conferencia realizada en 1901 en la universidad de
París, Jean Perrin –si, el mismo que demostró la existencia de los átomos
–propuso no solo un modelo del átomo planetario, sino una explicación para la
ionización de un gas, el cual es virtualmente el mismo que emplearías con el
modelo de Bohr (Perrin, 1901). Para Perrin el modelo de átomo debía ser el
de un núcleo –Sol –positivo y corpúsculos –planetas –con carga negativa. La
formación del rayo catódico se explica por el estímulo eléctrico sobre los
corpúsculos, liberándolos del núcleo.
Resulta relevante que este modelo planetario del átomo fuera
planteado con anterioridad al de Thomson y fuese aceptado solo 11 años más
tarde de la mano de Rutherford. La razón por la cual Thomson no adoptó de forma
temprana el modelo planetario de Perrin fue la misma por la cual el modelo
planetario de Rutherford nunca gustó del todo y fue la paradoja del “colapso
atómico”. La nube de carga positiva poco densa fue una primera solución a dicha
paradoja.
El
modelo dinámico de Lenard (1903)
Figura 6‑2.
Modelo atómico de Lenard
El término dinámico hace referencia a la unidad constitutiva
del modelo (Lenard, 1903),
al igual que el modelo de Thomson se trataban de esferas que contenían las
partículas subatómicas. Las principales diferencias eran que las
partículas poseían ambas cargas –el las llamó dinámidas –las cuales eran
responsables tanto de la carga como de la masa del átomo. La masa de un átomo
sería proporcional al número de dinámidas presentes en su interior.
El modelo
del anillo de Saturno de Nagaoka (1904)
Figura 6‑3.
Modelo atómico de Nagaoka
Este modelo del átomo mezcla aspectos del átomo planetario
de Perrin, con un intento de reconciliar el conflicto del “colapso del átomo”
con una explicación del espectro del hidrógeno (Nagaoka, 1904). Si les suena conocido este intento es porque es
en esencia el predecesor más directo del modelo atómico de Bohr. En 1859 James
Clerk Mazwell resolvió una controversia con respecto a la estabilidad de los
anillos de Saturno, mediante un cálculo teórico Maxwell propuso de los anillos
de Saturno eran una colección de satélites muy pequeños que mantenían su
estabilidad aun cuando se presentaran pequeñas alteraciones gravitacionales.
Nagaoka empleó la analogía para proponer que los electrones funcionaban de
forma similar a los satélites de Saturno y que se mantenían estables en sus
orbitas de forma análoga.
El modelo
del electrón fluido de Rayleigh (1906)
Figura 6‑4.
Modelo atómico de Rayleigh.
Rayleigh trató los electrones como si se tratara de un
superfluido (Rayleigh, 1906) debido a que los rayos catódicos debían
estar compuestos por miles de millones de partículas, mientras que el modelo de
Thomson solo trataba con una cantidad finita de electrones. Básicamente hace
referencia a los electrones como si formaran nubes –en el sentido más literal,
compuesta por miles de electrones –que podían vibrar. Aunque sus cálculos al
tomar a los electrones como nubes arrojaban valores discretos semejantes a los
de los espectros, estos no encajaban bien –específicamente con la fórmula de Rayleigh que era
empleada para determinar la compatibilidad de un modelo con las líneas
espectrales. Esto daría lugar a la revolución cuántica más adelante, pero en su
contexto solo fueron una extrañeza que fue ignorada.
El modelo de los electrones
vibratorios de Jeans (1906)
Figura 6‑5. Modelo
atómico de Jeans
Se trata de una expansión del modelo de Thomson (Jeans, 1906) en
el cual los electrones son descritos no como partículas sólidas, sino como
estructuras complejas con componentes internos que les permiten vibrar y emitir
energía con el fin de explicar las líneas espectrales. Los diferentes electrones
vibran con frecuencia diferente para explicar la diferente frecuencia de luz
emitida en un espectro como el del hidrógeno.
El modelo
de electrones expansivo de Schott (1906)
Figura 6‑6.
Modelo atómico de Schott.
El modelo de Scott solo tomaba en cuenta los electrones,
podría tratarse de una combinación del modelo de Jeans y del modelo de Nagaoka.
Los electrones orbitantes vibraban y se expandían alejándose del núcleo, pero
eran mantenidos en sus orbitas por la presión del éter (Schott, 1906).
Scott moriría defendiendo su modelo basado en la mecánica
clásica, aun en 1937 cuando todos ya habían aceptado la nueva física. El
problema del modelo de Scott era doble, al igual que los demás modelos no
explicaba las líneas espectrales en forma de la fórmula de Rayleigh, además se
trataba de un modelo regresivo que no podía hacer predicciones, solo explicar
los hechos tal cual eran planteados.
El modelo del
Arquión-electrón de Stark (1910)
Figura 6‑7.
Modelo atómico de Stark
En el modelo del arquión
se propone la presencia de una segunda partícula que pose carga positiva
llamada arquión. El electrón y el arquión se mueven en una órbita sin
núcleo formando un riel de carga positiva y negativa (Kragh, 2010).
Lo relevante de este modelo fue la intuición para la presencia de una partícula
positiva –que en los modelos posteriores sería denominada protón –pero al igual
que los demás modelos no encajaba para poder responder el problema de la
fórmula de Rayleigh
para los espectros.
El modelo cúbico de Lewis
(1916)
El átomo cúbico fue un modelo del átomo en el cual los
electrones estaban ubicados en las aristas de un cubo en un átomo no polar o
molécula. Este modelo fue desarrollado en 1902 por Gilbert N. Lewis y publicada
en 1916 (Lewis, 1916),
era un átomo diseñado específicamente para explicar las propiedades químicas
del átomo, específicamente el concepto de valencia para poder racionalizar la
regla de Abegg, mejor conocida como la ley del octeto (Jensen, 1984).
Esta fue desarrollada posteriormente en 1919 por Irving Langmuir como el átomo
del cubo-octeto (Kooser & Factor, 1983).
Figura 6‑8.
Modelo de Lewis. El modelo de Lewis es el origen para las
notaciones de pinto-electrón de Lewis, empleadas para explicar el enlace
químico clásico.
El problema con este átomo químico era que no hacía nada por
explicar los fenómenos cuánticos que, si podían ser calculados con exquisito
detalle por medio de los nuevos átomos físicos que se estaban proponiendo, como
el modelo atómico de Bohr de 1913 y el modelo atómico de Sommerfeld de 1916. A
pesar de que fue dejado de lado como modelo atómico, el modelo del átomo cubico
es de interés histórico ya que representa un paso para el entendimiento del
enlace químico, introduciendo conceptos como el enlace covalente, una forma de
representar la regla de Abegg y finalmente una representación de lo que
actualmente conocemos como la estructura de Lewis. Sin embargo, en la
actualidad la notación para las estructuras de Lewis se basa en el modelo de
Bohr pero representando únicamente los electrones del último nivel de energía.
El modelo atómico de Thomson
[Ciencias de Joseleg] [Química] [La materia] [El
átomo físico clásico] [Ejercicios
resueltos] [Introducción] [La
electricidad y el átomo] [La
constante de Faraday y la electrolisis] [Experimentos
con tubos de rayos catódicos] [Modelo
atómico de Thomson] [Otros
modelos atómicos clásicos] [Modelo
atómico de Rutherford] [Introducción
al núcleo atómico] [Estequiometría
de isótopos] [Referencias]
Desde los newtonianos se asumía que las partículas eran
divisibles, y la idea ya empezaba a ser fuertemente fundamentada para finales
del siglo XVIII por científicos como William Prout (1785-1850) y Joseph Norman
Lockyer (1836-1920). Prout argumentaba que el único elemento verdaderamente
indivisible debía ser el hidrógeno mediante un análisis de masas elementales (Prout, 1816; Prout & Thomson, 1816). En este sentido, la idea de
que los átomos de los elementos estaban formados por partículas aún más
fundamentales ya se encontraba en el aire, y después de casi 40 años de jugar
con los tubos de Crookes en 1897 Joseph John Thomson (1856-1940) prosiguió los experimentos de
Lenard y de Schuster para la relación tamaño, carga y masa de las partículas
que componían el rayo catódico. Thomson demostró que los rayos de Lenard
podrían viajar en el aire por una distancia más allá de la esperada para una
partícula del tamaño de un átomo (Raizer et al., 1991; Schonland, 1923;
Thomson, 1897, 1900; Whiddington, 1914).
Por lo anterior, el modelo de Thomson rompe al átomo de
Dalton en el sentido que plantea que el átomo es divisible y contiene
partículas en su interior, siendo la primera en identificarse el electrón. Fue
George Johnstone Stoney (1826-1911) en 1891 quien bautizó los electrones antes
de que Thmoson midiera su relación carga-masa de forma aproximada (Raizer
et al., 1991; Schonland, 1923; Thomson, 1897, 1900; Whiddington, 1914),
confirmando su existencia, por lo que el nombre ya existía de antes.
Sin embargo cuando hablamos de identificar al electrón no
nos referimos a aislar una partícula en super-microscopio, eso es imposible, lo
que hicieron los científicos fue estimar la relación de carga a masa, así como
la existencia de múltiplos de una carga constante.
La relación carga-masa del electrón
Mediante la comparación de la desviación de los rayos
catódicos por un campo eléctrico y otro magnético Thomson calculó un estimado
de la relación carga-masa. Thomson construyó un tubo de rayos catódicos que
tenía un agujero en el ánodo a través del cual pasaba un haz de electrones.
Placas cargadas eléctricamente y un imán se colocaron perpendiculares al haz de
electrones, y una pantalla fluorescente se colocó en un extremo.
Figura 5‑1. Tubo de rayos catódicos con campos magnéticos
y eléctricos perpendiculares. Los rayos catódicos (electrones) se originan en
el cátodo y se aceleran hacia el ánodo, que tiene un orificio en el centro. Un
estrecho haz de electrones pasa a través del agujero y viaja a la pantalla
fluorescente.
El campo eléctrico desvió los rayos en una dirección y el
campo magnético los desvió en la dirección opuesta. Thomson ajustó la fuerza de
los campos para que los efectos se equilibraran entre sí, permitiendo que los
electrones viajaran en línea recta hacia la pantalla. Conociendo las fuerzas
que resultaron en el camino recto, fue posible calcular un valor de 1.76 x 108
C/g para la relación entre la carga eléctrica del electrón y su masa.
En 1897, seis años después de haber sido bautizados, Thomson
aún se encontraba atascado, pues los trabajos de Hertz sobre la carga del
electrón habían dado negativo y aparentemente los resultados de Schuster aún no
eran conocidos. Thomson también realizó el experimento de Hertz y al igual que
Schuster encontró que la carga de los corpúsculos debía ser negativa.
La carga del electrón
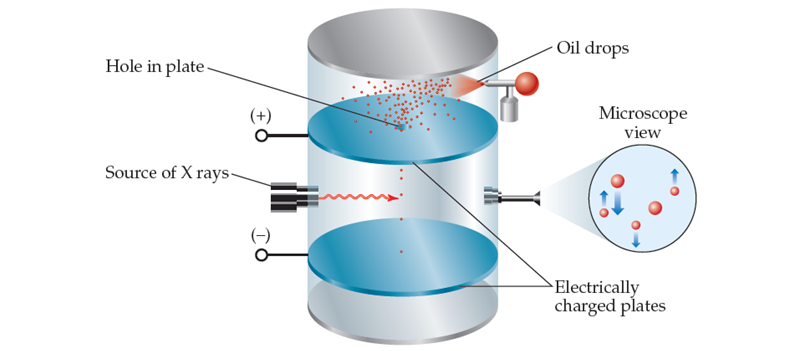
Sin embargo, esta estimación fue corregida en 1909 mediante
el experimento de Millikan, también conocido como el experimento de la gota de
aceite cuyos resultados fueron publicados en 1913 (Millikan, 1913).
Figura 5‑2.
Diseño experimental del experimento de la gota de aceite.
Experimento de la gota de aceite de Millikan para medir la
carga del electrón se representa en la Figura 5‑2,
en este se permite que pequeñas gotas de aceite caigan entre placas cargadas
eléctricamente. Las gotas recogen electrones adicionales como resultado de la
irradiación de rayos X y, por lo tanto, se cargan negativamente. Millikan midió
cómo la variación del voltaje entre las placas afectaba la tasa de caída. A
partir de estos datos calculó la carga negativa de las gotas. Debido a que la
carga de cualquier gota siempre era un múltiplo entero de 1.602 x 10-19
coulombios (C), Millikan dedujo que este valor era la carga de un solo
electrón. Ahora con la relación masa carga y la carga del electrón fue posible
estimar la masa del electrón.
Ejercicio. Estimar la masa de un electrón si su carga elemental
absoluta es de 1.602 x 10-19 C y su relación masa carga es de 1.76 x
108 C/g y compararla con la masa de un solo átomo de hidrógeno.
Los experimentos de Thomson sugirieron las partículas que
componían los rayos catódicos eran mil veces más pequeñas que el átomo de
hidrógeno y que su masa era inespecífica para cualquier elemento productor de
rayos catódicos. En otras palabras, los átomos de todos los elementos gaseosos
que podían emplearse en un tubo de Crookes lanzaban la misma partícula, con la
misma masa y la misma carga. Thomson llamó originalmente a estas partículas
como corpúsculos, pero otros científicos propusieron el nombre que ha sido
aceptado para para la posteridad, el electrón.
El
modelo culinario del átomo
Ahora solo restaba construir un modelo del átomo que pudiera
dar una representación pictórica para los datos que habían sido obtenidos
mediante los experimentos con los tubos de Crookes. En primera instancia, los
gases de los elementos empleados no eran afectados por campos magnéticos, por
lo que su carga neta debía ser neutral. En segunda instancia, cuando estos eran
estimulados por un fuerte campo eléctrico emitían los electrones, los cuales
eran partículas muy pequeñas, de carga negativa. Con los datos recolectados
Thomson concluyó que los electrones emergían del interior del átomo –en
consecuencia, dividiéndolo –y mediante un razonamiento inverso razonó que en un
gas sin estimular, los electrones debían estar al interior del átomo.
Figura 5‑3.
Joseph John "J.J." Thomson (Reino Unido: Mánchester, Inglaterra, 18 de
diciembre de 1856-Cambridge, Inglaterra, 30 de agosto de 1940) fue un científico
británico, descubridor del electrón, de los isótopos e inventor del
espectrómetro de masa. En 1906 fue galardonado con el Premio Nobel de Física.
Para explicar la carga neutra neta del gas sin estimular
Thomson asumió que el átomo como tal debía estar compuesto por una masa
dispersa de carga positiva. Esta es la esencia del modelo de Thomson para el
átomo o modelo del pastel con pasas propuesto para 1904. A pesar de su
representación estacionaria, los electrones debían moverse en el interior del átomo
estimulados por la repulsión de la masa positiva y de los demás electrones en
su interior (Arabatzis, 2009; Dahl, 1997; Thomson, 1897).
Figura 5‑4.
Modelo atómico de Thomson. Por más culinario que pueda parecer,
el modelo de Thomson expandía el antiguo modelo del átomo esférico con
partículas en su interior, estas eran estimuladas por el campo eléctrico
formando los rayos catódicos
Explicación
para el rayo catódico, la ionización de un gas
Un rayo catódico se genera por la acumulación de energía en
los electrones de un gas. El gas se ioniza emitiendo el electrón, el cual viaja
al polo positivo más cercano. Normalmente, los gases se encuentran a demasiada
presión como para que los electrones viajen demasiada distancia sin impactar
con otro átomo (Arabatzis, 2009; Brok, 2005; Raizer, Kisin, & Allen,
1991). En los tubos de Geissler esto era lo que pasaba, cuando el electrón
golpea el gas la energía se transfiere al segundo átomo y este la emite no como
otro electrón excitado, sino como un fotón de luz, causando la
luminiscencia.
Los rayos catódicos no emiten fotones sino cuando impactan
con otros materiales, por esta razón no se ven sino hasta que golpean con el
vidrio o la pintura fluorescente. Debido a la limitación de la presión, los
rayos catódicos solo se hicieron posibles hasta que la tecnología de las bombas
de descompresión se hizo lo bastante efectiva como para descomprimir el
interior de un tubo de vidrio lo suficiente como para que quedasen pocos átomos
del gas dispersos.
Televisores CTR
El tubo de rayos catódicos (CRT, del inglés Cathode Ray
Tube) es una tecnología que permite visualizar imágenes mediante un haz de
rayos catódicos constantemente dirigido contra una pantalla de vidrio
recubierta de fósforo y plomo (YouTube)
(YouTube).
El fósforo permite reproducir la imagen proveniente del haz de rayos catódicos,
mientras que el plomo bloquea los rayos X para proteger al usuario de sus
radiaciones. Fue desarrollado por William Crookes en 1875. Se emplea
principalmente en monitores, televisores y osciloscopios, aunque en la
actualidad se está sustituyendo rápidamente por tecnologías como plasma, LCD,
LED. Además, a día de hoy son muy difíciles de encontrar.
Consecuencias
del modelo atómico de Thomson
El modelo atómico de Thomson no tuvo mayores repercusiones
como tal ya que no podía explicar otros aspectos de la investigación de los
elementos como las líneas de los espectros electromagnéticos o la configuración
periódica de los elementos. En lo que si fue importante fue en el de
popularizar la idea de que los átomos estaban constituidos por una estructura
interna no trivial que posiblemente podría condicionar las relaciones de estos
elementos durante las reacciones químicas. Desde este punto para la siguiente
década 1910-1920, los nuevos modelos del átomo deberían poder explicar: los
electrones como parte de la estructura atómica, los espectros de emisión de un
elemento y la configuración periódica de los elementos. No menos importante fue
el impacto de las ideas de Thomson en sus alumnos, especialmente en la del
joven Ernest Rutherford (1871-1937), quien llevaría la historia del átomo al
siguiente nivel. Finalmente, el modelo de Thomson representa la primera
culminación de estudios del átomo hechos desde la perspectiva de la física, los
experimentos con los tubos de Crookes daban los mismos resultados sin importar
la naturaleza elemental del gas implicado, en consecuencia, el concepto de
reacción química no era empleado para estudiar el átomo. En resumen, con el
modelo de Thomson abandonamos la química de átomo y nos adentramos en la física
del átomo.
La carga del protón
El descubrimiento del protón data de las primeras investigaciones
de la estructura atómica. Mientras estudiaban corrientes de átomos y moléculas
gaseosos ionizados a los que se les habían quitado los electrones, Wilhelm Wien
(1898) y J.J. Thomson (1910) identificaron una partícula positiva igual en masa
al átomo de hidrógeno, pero cargada positivamente empleando los rayos canales.
Goldstein observó que en un tubo provisto de un cátodo
perforado que contenía un gas enrarecido, un haz de rayos de luz (rayos del
canal) pasaba a través de cada perforación en dirección opuesta a la
trayectoria de los rayos catódicos (electrones). Los campos magnéticos
relativamente débiles que utilizó no producían una desviación perceptible de
estos rayos de luz. Sin embargo, los campos magnéticos idénticos desviaban
fuertemente los rayos catódicos. Su conclusión fue que para los rayos del canal
observados estaba tratando con un fenómeno que no podía explicar.
Nos interesa principalmente el protón, un rayo canal. Sin
embargo, el nombre rayo canal surgió de un fenómeno general. Goldstein,
mientras experimentaba con varios gases, no solo con hidrógeno, notó que estos
extraños rayos cambiaban de color de gas a gas. Sugirió llamarlos rayos de
canal hasta que alguien seleccionara un nombre adecuado. Su nombre provisional
se convirtió en el nombre aceptado.
Fue Wilhelm Wien, quien reconoció que los rayos de canal
eran partículas cargadas positivamente. Observó que uno no podía distinguirlos
visualmente de los rayos catódicos débiles, pero incluso con un imán de
herradura débil, los rayos catódicos podían desviarse y los rayos del canal no
se desviaban notablemente aunque sí levemente. Esto se debe a que la masa del
protón es más grande y en consecuencia su momento cinético es mayor, por lo que
un campo magnético aunque los afecta, no logra desviarlos significativamente,
algo semejante a un proyectil de papel en comparación con un proyectil de plomo
sometidos a una corriente de aire.
Wien, señaló que la desviación electrostática servía como un
buen medio para identificar los rayos del canal, ya que los rayos del canal se
desviaban hacia el polo negativo del dispositivo electrostático, lo cual
sugería su carga positiva.
También declaró específicamente que la electricidad positiva
transportada por los rayos del canal era una característica de identificación
de los rayos. Wien diseñó equipos de deflexión que utilizan potenciales de
hasta 30 000 voltios y determinó relaciones carga-masa para el protón con un
valor aproximado de 1.0 x 104 C/g. Sus resultados concuerdan
bastante bien con los obtenidos por investigadores posteriores 0.478 x 104
C/g. La relación carga-masa para el hidrógeno se conocía a partir de
experimentos de electrólisis que databan de la década de 1830. Era alrededor de
1.0 x 105 C/g en esa época. El hidrógeno tenía la mayor relación carga-masa
en comparación con otros elementos, porque era el elemento más ligero.
Ejercicio. Calcular la masa de un solo átomo de hidrógeno, y
con su relación carga masa 0.478 x 104 C/g determinar la carga de un
átomo en coulombios.
A partir de sus medidas sobre las descargas a través del
hidrógeno, dijo que fácilmente se llega a la opinión de que los rayos del canal
son los propios iones de hidrógeno. Por lo tanto, parece que Wien debe
atribuirse el mérito de lo siguiente: el reconocimiento de que los rayos del
canal producidos en las descargas eléctricas en gas hidrógeno a baja presión
son partículas cargadas positivamente, el reconocimiento de que estos rayos
contienen iones de hidrógeno y las primeras mediciones de la relación
carga-masa del protón.
En mayo de 1907, J.J. Thomson confirmó las medidas de Wien
con un artículo titulado "On rays of
Positive Electricity". En estos experimentos y mediciones de carga-masa,
Thomson utilizó un aparato mejorado y una mayor sofisticación experimental y
observó tanto el protón como lo que parece ser el catión de la molécula de
hidrógeno (Moore, Jaselskis, & von Smolinski, 1985).
Primeros indicios de que la masa de un elemento no es constante
Uno de los postulados fundamentales de la teoría atómica
clásica era el axioma de que la masa de un elemento ponderada a un mol de
sustancia permitía identificar su identidad, por ejemplo un elemento de 16.00
g/mol es oxígeno, sin embargo los experimentos de Thomson comenzaron a indicar
que esta idea no era tan cierta después de todo.
Thomson determinó la relación carga-masa de los rayos del
canal, y descubrió que variaba según el tipo de gas que estaba presente en el
tubo. También hubo variaciones sutiles dentro de cada valor para cada elemento
usado. En otras palabras, cuando se usaba hidrógeno, cloro, nitrógeno o neón,
cada uno tenía un valor carga-masa diferente de los demás. En el caso del neón,
a medida que el equipo y la técnica de Thomson mejoraron, notó que el neón daba
dos puntos (muy cerca uno del otro) al mismo tiempo. En otras palabras, la
misma muestra de neón estaba produciendo dos relaciones carga-masa ligeramente
diferentes, que actualmente se explican cómo dos isótopos diferentes del neón,
cada uno con las mismas propiedades químicas, pero con una masa ligeramente
diferente.
¿Por qué el protón no aparece en este modelo?
Aunque Thomson sabía de su existencia y conocía su relación carga masa no conocía su volumen, en consecuencia lo modelo como una entidad de volumen amplio y disperso, la masa del pastel más pequeño de su modelo. De hecho la presunción de que el electrón existiera al interior del protón en el elemento hidrógeno tenía sentido puesto que el protón es casi 1500 veces más masivo. El presupuesto de que la masa del protón era poco densa y dispersa en un volumen amplio sería un problema para otra generación de científicos
2. La electricidad y el átomo | ⚛️ El átomo físico clásico | Joseleg
[Ciencias de Joseleg] [Química] [La materia] [El
átomo físico clásico] [Ejercicios
resueltos] [Introducción] [La
electricidad y el átomo] [La
constante de Faraday y la electrolisis] [Experimentos
con tubos de rayos catódicos] [Modelo
atómico de Thomson] [Otros
modelos atómicos clásicos] [Modelo
atómico de Rutherford] [Introducción
al núcleo atómico] [Estequiometría
de isótopos] [Referencias]
La materia exhibe propiedades químicas y físicas, mientras
que las propiedades químicas se enfocan en la reactividad, las propiedades
físicas se basan en interacciones que no alteran la identidad de la sustancia,
pero que en muchas ocasiones dependen del tipo de sustancia. Una propiedad
física particularmente desconcertante era la electricidad.
Etimología de electricidad
Los antiguos griegos notaron que el ámbar atraía pequeños
objetos cuando se frotaba con la piel. Junto con los rayos, este fenómeno es
una de las primeras experiencias registradas de la humanidad con la
electricidad (Ahuja, 1600).
En su tratado De Magnete de 1600, el
científico inglés William Gilbert acuñó el nuevo término latino electrica, para referirse a aquellas
sustancias con propiedades similares a las del ámbar que atraen objetos pequeños
después de ser frotadas (Gilbert, 1600). La palabra electricidad se deriva del latín ēlectrum (también la raíz de la aleación
del mismo nombre), que proviene de la palabra griega para ámbar, ἤλεκτρον (ēlektron).
Figura 2‑1. William Gilbert,
(Colchester, Essex, 24 de mayo de 1544–Londres, 10 de diciembre de 1603) fue un
filósofo natural y médico inglés. Es considerado uno de los pioneros del
estudio científico del magnetismo. Su obra maestra es De Magnete (1600), el primer libro importante sobre Física
publicado en Inglaterra. Introdujo el término electricidad a partir de sus
estudios sobre electrostática. Rechazó con vigor la filosofía aristotélica y el
método escolástico de enseñanza en las universidades.
Dos tipos de carga
A principios de la década de 1700, el químico francés
Charles François du Fay descubrió que, si una hoja de oro cargada es rechazada
por vidrio frotado con seda, entonces la misma hoja de oro cargada es atraída
por el ámbar frotado con lana. A partir de este y otros resultados de tipos
similares de experimentos, du Fay concluyó que la electricidad consta de dos
fluidos eléctricos, fluido vítreo de vidrio frotado con seda y fluido resinoso
de ámbar frotado con lana. Estos dos fluidos pueden neutralizarse entre sí
cuando se combinan (Benjamin, 1895; Keithley, 1999).
Figura 2‑2. Charles François de
Cisternay du Fay (París, 1698 – 1739) fue un físico y químico francés,
superintendente del Jardin du Roy. De familia prominente con influencia en
ambientes militares y eclesiásticos, su padre le consiguió el nombramiento de
químico adjunto en la Academie des
Sciences. Aún sin tener una formación científica, Du Fay, pronto destacó en
sus experimentos sobre la electricidad al enterarse de los trabajos de Stephen
Gray, dedicó su vida al estudio de los fenómenos eléctricos. Publicó sus
trabajos en 1733 siendo el primero en identificar la existencia de dos tipos de
cargas eléctricas (las denominadas hoy en día positiva y negativa), que él
denominó carga vítrea y carga resinosa, debido a que ambas se manifestaban: de
una forma al frotar, con un paño de seda, el vidrio (carga positiva) y de forma
distinta al frotar, con una piel, algunas sustancias resinosas como el ámbar o
la goma, (carga negativa). Las observaciones de Du Fay en electricidad fueron
escritas en diciembre de 1733 y luego impresas en el v. 38 de la Philosophical Transactions of the Royal
Society en 1734 (Farrar, 1969).
Figura 2‑3. Benjamin Franklin
(Boston, 17 de enero de 1706-Filadelfia, 17 de abril de 1790) fue un político,
polímata, científico e inventor estadounidense. Es considerado uno de los
Padres Fundadores de los Estados Unidos.
Más tarde, el científico estadounidense Ebenezer Kinnersley
también llegó de forma independiente a la misma conclusión (μκρκ, 1900).
Una década más tarde, Benjamin Franklin propuso que la electricidad no provenía
de diferentes tipos de fluidos eléctricos, sino de un solo fluido eléctrico que
mostraba un exceso (+) o un déficit (-). Les dio la nomenclatura de carga
moderna de positivo y negativo respectivamente (Erwin, 1995; Singh, 2012). Franklin pensó que el
portador de carga era positivo, pero no identificó correctamente qué situación
era un excedente del portador de carga y qué situación era un déficit (Myers & Myers, 2006).
Entre 1838 y 1851, el filósofo natural
británico Richard Laming desarrolló la idea de que un átomo está compuesto por un núcleo de
materia rodeado de partículas subatómicas que tienen cargas eléctricas
unitarias (Farrar, 1969).
A partir de 1846, el físico alemán William Weber teorizó que la electricidad
estaba compuesta de fluidos cargados positiva y negativamente, y su interacción
se regía por la ley del cuadrado inverso. Después de estudiar el fenómeno de la
electrólisis en 1874, el físico irlandés George Johnstone Stoney sugirió que
existía una "única cantidad definida de electricidad", la carga de un
ion monovalente. Pudo estimar el valor de esta carga elemental e por medio de
las leyes de electrólisis de Faraday (Farrar, 1969).
Sin embargo, Stoney creía que estas cargas estaban unidas permanentemente a los
átomos y no podían eliminarse. En 1881, el físico alemán Hermann von Helmholtz
argumentó que tanto las cargas positivas como las negativas se dividían en
partes elementales, cada una de las cuales "se comporta como átomos de electricidad" (Arabatzis, 2006).
Stoney acuñó inicialmente el término electrolión en 1881. Diez años más tarde, cambió a electrón para describir estas cargas
elementales, escribiendo en 1894: "... se
hizo una estimación de la cantidad real de esta unidad fundamental de
electricidad más notable, para la cual Desde entonces me he aventurado a
sugerir el nombre de electrón. La palabra electrón es una combinación de
las palabras eléctrico e iónico. El sufijo -on que ahora se usa para designar
otras partículas subatómicas, como un protón o un neutrón, se deriva a su vez
del electrón (Arabatzis, 2006).