[Ciencias de Joseleg] [Química] [La materia] [El
átomo químico] [Ejercicios
resueltos] [Introducción] [Generalidades] [El
atomismo filosófico] [Introducción
a las leyes ponderales] [Ley
de la conservación de la masa] [Ley
de las proporciones definidas] [Ley
de las proporciones recíprocas] [Ley
de las proporciones múltiples] [Teoría
atómica de Dalton] [Postulado
de composición] [Postulado
de identidad atómica] [Postulado
de identidad molecular] [Postulado
de asociación] [Postulado
de la ecuación química] [Pesos
atómicos] [La
hipótesis de Avogadro] [La
técnica de Cannizzaro] [Del
molécula-gramo al mol] [Del
mol a la cantidad de sustancia] [Historia
de la teoría cinética] [Modelo
matemático de la teoría cinética] [Estequiometría
de composición] [Ley
de Dulong y Petit] [Referencias]
El átomo es la unidad de materia más pequeña que
puede participar en una reacción química.
Para Dalton los elementos eran monoatómicos es decir átomos
libres, y las moléculas siempre eran polielementales, es decir, compuestas por
distintos elementos. Por lo anterior la síntesis de agua por combustión de
hidrógeno se representaba como:
Figura 14‑1. Síntesis de agua usando el modelo atómico de
Dalton original. Recuerde que para Dalton los elementos como hidrógeno
(gris/pequeño) y oxígeno (rojo/grande) estaban compuestos por un solo átomo.
Uso de los símbolos atómicos
En la actualidad sabemos que los átomos libres rara vez
existen en la naturaleza, sin embargo, el postulado de la ecuación química
puede entenderse como que los átomos no cambian su identidad en la ecuación
química, por lo que esta se entiende como una reorganización de las posiciones
de los átomos y del modo en que se unen a otros átomos, pero la cantidad de
átomos total, así como la cantidad de átomos de cada elemento se conserva.
Dado que emplear colores y esferas se hace inconveniente,
las ecuaciones químicas normalmente se traducen a un modelo simbólico que
reemplaza las esferas daltonianas por el símbolo atómico.
Figura 14‑2. Desplazamiento del hidrógeno por el zinc en
la ecuación química Zn + H2S →
ZnS + H2.
El número estequiométrico y el número de eventos de reacción
Cuando analizamos una reacción química, normalmente el
número de átomos de un determinado elemento es algo más complicado, esto debido
a que el número de moléculas no está dado en una medida absoluta, sino en una
medida relativa a un evento de reacción.
Un evento de reacción (Nξ)
representa el conjunto mínimo de átomos y moléculas necesario para que la
reacción ocurra una vez como mínimo, asumiendo una interpretación molecular de
la materia. Por ejemplo:
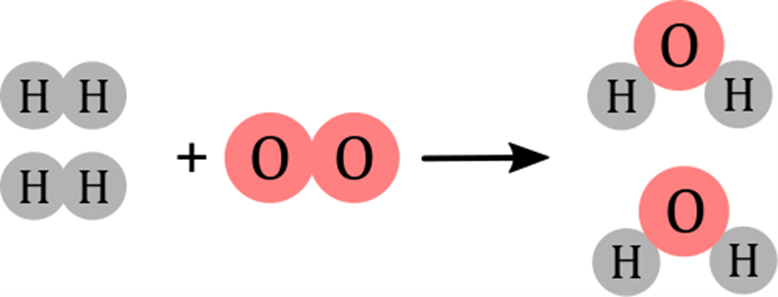
Figura 14‑3. Síntesis de agua en la hipótesis de Avogadro.
Aunque Dalton no la modelo de este modo, es el ejemplo más simple para
introducir el concepto de número estequiométrico. El número estequiométrico es
el número de veces que una molécula se repite en un solo evento de reacción,
por ende, el número estequiométrico del hidrógeno es 2, el del oxígeno es 1, y
del del agua es 2. Al contar números estequiométricos contamos moléculas, pero
su composición atómica es irrelevante.
Número estequiométrico
El número de veces que se
repite una determinada molécula se conoce como número
estequiométrico o coeficiente estequiométrico, su símbolo moderno es (vi). El número
estequiométrico es fácil de identificar en las reacciones anteriores, pues en
el desplazamiento de zinc a hidrógeno todos los números estequiométricos son
uno, mientras que en la síntesis de agua tenemos v(H2)=2, v(O2)=1
y v(H2O)=2. El número
estequiométrico es adimensional, y se encuentra en ecuaciones químicas como el
número que está a la izquierda de la fórmula molecular, por ejemplo:
Ejemplo. Determine el número estequiométrico de cada
una de las moléculas en la reacción química N2 + 3H2 →
2NH3
Ejemplo. Determine el número estequiométrico de cada
una de las moléculas en la reacción química 2NaClO3 → 2NaCl + 3O2
Una reacción real no ocurre una sola vez, existe una
cantidad indeterminada de eventos de reacción, que deben tomarse en cuenta,
aunque sea de manera teórica por medio del parámetro número de eventos de
reacción (Nξ). El número de moléculas mínimo involucrado en
un solo evento de reacción lo expresaremos como el número estequiométrico.
Ejemplo. ¿Cuántas
moléculas de amoníaco (NH3) están presentes en una reacción química
que ocurrió 2.2 x 1025 veces? Tenga en cuenta la siguiente ecuación
química definida para un solo evento de reacción N2 + 3H2 → 2NH3.
Química la Ciencia Central 13
Práctica
3.1.1. En
el siguiente diagrama, las esferas blancas representan átomos de hidrógeno y
las esferas azules representan átomos de nitrógeno. Los dos reactivos se
combinan para formar un solo producto, amoníaco, NH3, que no se muestra.
Escribe una ecuación química balanceada para la reacción. Con base en la ecuación
y el contenido del cuadro de la izquierda (reactivos), encuentre cuántas moléculas
de NH3 deben mostrarse en el cuadro de la derecha (productos). (a) 2, (b) 3,
(c) 4, (d) 6, (e) 9.
Práctica
3.1.2. En
el siguiente diagrama, las esferas blancas representan átomos de hidrógeno, las
esferas negras átomos de carbono y las esferas rojas átomos de oxígeno. En esta
reacción, hay dos reactivos, etileno, C2H4, que se
muestra, y oxígeno, O2, que no se muestra, y dos productos, CO2
y H2O, ambos se muestran. (a) Escriba una ecuación química
balanceada para la reacción. (b) Determine el número de moléculas de O2
que deben mostrarse en el cuadro de la izquierda (reactivos).
Ejercicio
3.1. La
reacción entre el reactivo A (esferas azules) y el reactivo B (esferas rojas)
se muestra en el siguiente diagrama. Con base en este diagrama, ¿qué
ecuación describe mejor la reacción? (a) A2 + B →
A2B (b) A2 + 4 B → 2 AB2
(c) 2 A + B4 → 2 AB2 (d) A + B2
→ AB2
Ejercicio
3.3. El
siguiente diagrama representa la colección de elementos formados por una reacción
de descomposición. (a) Si las esferas azules representan átomos de N y las
rojas representan átomos de O, ¿cuál era la fórmula empírica
del compuesto original? (b) ¿Podría dibujar un diagrama que
represente las moléculas del compuesto que se ha descompuesto? ¿Por
qué o por qué no?
Ejercicio
3.6. El
siguiente diagrama representa una reacción a alta temperatura entre CH4
y H2O. Con base en esta reacción, encuentre cuántos moles de cada
producto se pueden obtener a partir de 4.0 mol de CH4.
Ejercicio
3.7. El
nitrógeno N2 y el hidrógeno H2 reaccionan para formar
amoníaco NH3. Considere la mezcla de N2 y H2
que se muestra en el diagrama adjunto. Las esferas azules representan N y las
blancas representan H. Dibuje una representación de la mezcla de productos,
suponiendo que la reacción se completa. ¿Cómo llegaste
a tu representación? ¿Cuál es el reactivo limitante
en este caso?
Ejercicio
3.8. El
monóxido de nitrógeno y el oxígeno reaccionan para formar dióxido de nitrógeno.
Considere la mezcla de NO y O2 que se muestra en el diagrama adjunto. Las
esferas azules representan N y las rojas representan O. (a) Dibuje una
representación de la mezcla de productos, suponiendo que la reacción se
completa. ¿Cuál es el reactivo limitante
en este caso? (b) ¿Cuántas moléculas de NO2
extraería como productos si la reacción tuviera un rendimiento porcentual del
75 %?
Por lo tanto, podemos reescribir la ecuación del número de
átomos de un elemento como:
DEMOSTRACIÓN. Como
calcular el número de átomos de un elemento en una molécula si se conoce
cuantas veces ocurre la reacción y cuantas moléculas de la sustancia se
consumen. Deduzca una ecuación para el caso de que el elemento se encuentre en
una sola molécula y para el caso de que el elemento se encuentre en más de una
molécula
Ejemplo. Cuantos
átomos de hidrógeno están presentes en el hidrógeno molecular H2 en
una reacción de síntesis de amoniaco que se repite 4.2 x 1020 veces.
Tenga en cuenta la siguiente ecuación química definida para un solo evento de
reacción N2 + 3H2 → 2NH3
Ejemplo. Cuantos
átomos de hidrógeno están en la siguiente ecuación química CaH2 +
2HCl → CaCl2 + 2H2 la cual repite 4.3 x 1019
veces.