Para ver directo en YouTube: https://youtu.be/i0zX22GiaKw
Mas ejercicios resueltos de química sobre del átomo
químico:
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/ejercicios-resueltos-sobre-el-atomo.html
Veremos cómo comparar rápidamente los porcentajes en masa de dos
elementos en un mismo compuesto sin realizar cálculos precisos. Teórica atómica clásica, el
átomo de los químicos.
Enunciado: (Química Chang10 repaso 3.10) Sin hacer cálculos detallados, estime si la composición porcentual en
masa de Sr es mayor o menor que la del O en el nitrato de estroncio [Sr(NO3)2].
Iniciamos la solución de este ejercicio con la ley de composición molecular que establece que el número de átomos de un elemento dado es igual a multiplicar el subíndice de ese mismo elemento por el número de moléculas.
Posteriormente aplicamos implícitamente la tercera ley de Avogadro podemos reemplazar el número de átomos o de moléculas por el producto, número de Avogadro por cantidad de sustancia y cancelamos, número de Avogadro a ambos lados de la ecuación.
Reemplazamos la cantidad de sustancia por el cociente de masa dividido la masa molar. Para ambos, el elemento y el compuesto.
Despejamos el cociente masa del elemento sobre masa del compuesto.
Reemplazamos el cociente masa del elemento sobre masa del compuesto por la unidad denominada fracción de masas.
Multiplicamos a ambos lados de la ecuación por 100 a la izquierda, eso convierte la fracción de masas en el porcentaje en peso o porcentaje en masa y a la derecha multiplicamos por el 100 de manera explícita.
Con lo
anterior nos podemos dar cuenta que el 100 y la masa molar del compuesto son
factores constantes y que el porcentaje en peso de un elemento depende
directamente del subíndice y su masa molar respectiva, así que vamos a evaluar
esos 2 términos para los elementos involucrados. Tenga en cuenta que su índice
del oxígeno que aparece en la fórmula molecular no es el real, porque todo el
grupo nitratos está repitiendo 2 veces. Eso significa que el subíndice del oxígeno
que aparece explícitamente como 3 también se está repitiendo 2 veces y, por lo
tanto, el verdadero subíndice, el oxígeno será 6.
Estroncio = 1 x 87.62 = 87.62
Oxigeno = 6 x 16.00 = 96.00
Cuando
analizamos los términos importantes, nos damos cuenta de que el oxígeno posee
un mayor aporte y por lo tanto eso va a repercutir en un mayor porcentaje en
masa. Por lo anterior podemos concluir que el porcentaje en masa del estroncio
es menor que el porcentaje en masa del oxígeno.
Suscríbete a nuestro canal
#cienciasdejoseleg:
No olviden
consultar nuestro web
“https://quimicadejoseleg-lamateria.blogspot.com/p/la-materia.html”
parte de
nuestra serie de blogs de #cienciasdejoseleg, donde encontrarán:
Fundamentos
teóricos y referencias bibliográficas del átomo químico:
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/el-atomo-quimico.html
Mas
ejercicios resueltos de química sobre del átomo químico:
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/ejercicios-resueltos-sobre-el-atomo.html
Litas de reproducción
Teoría de química de gases
https://www.youtube.com/watch?v=inKrsI1Q62M&list=PL6Meh2AYBnRRPLxFTi8NEhiEHBU41GJYx
Ejercicios de química de gases
https://www.youtube.com/watch?v=v-DWhpx3GUM&list=PL6Meh2AYBnRQAcpspGaVZ9f6pxFIaeNtE
Teoría atómica clásica
https://www.youtube.com/watch?v=fzmZsq9g0Mo&list=PL6Meh2AYBnRRw6jH4G05yNO1tikzvhRlX
Ejercicios de teoría atómica clásica
https://www.youtube.com/watch?v=BIfu580WyXs&list=PL6Meh2AYBnRS_JaSplKJ1EHQ6xyEg8ApS
Teoría de estequiometría
https://www.youtube.com/watch?v=1gl27UWBY7A&list=PL6Meh2AYBnRRD0snAxc6HmyI1KTviZrk8
Ejercicios resueltos de estequiometría
https://www.youtube.com/watch?v=RIclbdX0hPs&list=PL6Meh2AYBnRTwQsL2AGlXoL1d9eS3cOfi
Teoría de disoluciones
https://www.youtube.com/watch?v=hfUROJ11ykE&list=PL6Meh2AYBnRSpJ0h0gdmZWXYeTONl5Q-L
Ejercicios resueltos de disoluciones
https://www.youtube.com/watch?v=Yt7jK_uvn9U&list=PL6Meh2AYBnRQZJ1Pt-lA162YT4u3sjY4R


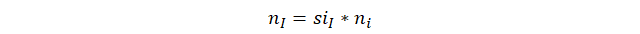




No hay comentarios:
Publicar un comentario