⚛️ En este tutorial veremos cómo calcular la relación moles de A a moles de B, una de las relaciones estequiométricas fundamentales. ⚛️. Teoría atómica clásica
Teniendo en cuenta la siguiente ecuación
química balanceada: (2KMnO4+8H2SO4+10FeSO4→2MnSO4+8H2O+Fe2(SO4)3+K2SO4).
Determine cuantos moles de ácido sulfúrico (H2SO4) se
produce con 1,74 moles de sulfato de potasio (K2SO4).
YouTube: https://youtu.be/Scr66tybkec
- Identificamos los números estequiométricos
respectivos v(H2SO4) = 8; v(K2SO4)=1.
- Invocamos la ecuación estequiométrica
fundamental, radio de cantidad de sustancia igual al radio de números
estequiométricos.
- Despejamos la cantidad de sustancia de la
incógnita.
- Dado que el enunciado nos dice las moles de
sulfato de potasio, asumiremos que el ácido sulfúrico es la incógnita.
Suscríbete a nuestro canal
#cienciasdejoseleg: https://www.youtube.com/channel/UCoHZZK6xQl_NxIndVdeFgSw?sub_confirmation=1
No olviden consultar
nuestro web “https://quimicadejoseleg-lamateria.blogspot.com/p/la-materia.html” parte de nuestra serie de blogs de
#cienciasdejoseleg, donde encontrarán:
Fundamentos teóricos y
referencias bibliográficas de la teoría atómica clásica: https://quimicadejoseleg-lamateria.blogspot.com/2021/06/el-atomo-quimico.html
Mas ejercicios resueltos de
química sobre la teoría atómica clásica: https://quimicadejoseleg-lamateria.blogspot.com/2021/06/ejercicios-resueltos-sobre-el-atomo.html

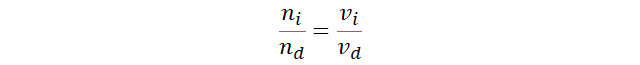


No hay comentarios:
Publicar un comentario