🎈 En este tutorial de química del capítulo de química de gases, veremos cómo la presión final en un problema de cambios relativos como comprimir el gas a la mitad del volumen, disminuir la temperatura a la mitad o a agregar más moles. 🎈 química de gases.
Un gas originalmente
se encuentra a 2 mol de sustancia, 2 atm de presión, 2 L de volumen y 0°C.
Indique la presión del gas, si el volumen se comprime a la mitad, se agregan 2
moles de sustancia, y la temperatura disminuye a la mitad.
YouTube https://www.youtube.com/watch?v=QhGUDxK_4_s
- Usamos la ley de los gases ideales, pero en
su forma dinámica para diferenciar entre el estado inicial y el final:
- Despejamos la presión final.
- Establecemos ecuaciones auxiliares según las
indicaciones del enunciado, primero el volumen final es la mitad del inicial.
- La cantidad de
sustancia final es igual a la inicial más 2 mol.
- La temperatura
disminuye a la mitad.
- Reemplazamos en la
ecuación dinámica.
- El 2 que divide a
una división en realidad está multiplicando y cancelamos términos semejantes.
- Reemplazamos.
Suscríbete a nuestro canal
#cienciasdejoseleg:
https://www.youtube.com/channel/UCoHZZK6xQl_NxIndVdeFgSw?sub_confirmation=1
No olviden consultar
nuestro web “https://quimicadejoseleg-lamateria.blogspot.com/p/la-materia.html”
parte de nuestra serie de blogs de #cienciasdejoseleg, donde encontrarán:
Fundamentos teóricos y
referencias bibliográficas química de gases:
https://quimicadejoseleg-lamateria.blogspot.com/p/quimica-de-gases.html
Mas ejercicios resueltos de
química sobre la química de gases:

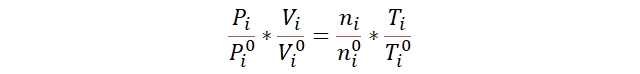



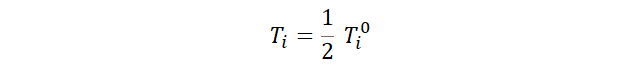



No hay comentarios:
Publicar un comentario