🎈 En este tutorial de química del capítulo de química de gases, veremos cómo calcular el volumen de un gas a partir de la ley de los gases ideales en caso de que usted hubiera olvidado la ley de Boyle. 🎈 química de gases.
(Gases 1. Matamala y González) Cierta masa de
gas ocupa 45 ml a 0°C y 650 mm de Hg. ¿Qué volumen ocuparía en CN?
YouTube: https://www.youtube.com/watch?v=oEFKbahWubc
- Partimos de la ley de los gases ideales
- Tachamos los valores constantes que en este caso es cantidad de
sustancia debido a que no la mencionan y la temperatura ya que 0 °C es la
temperatura en condiciones normales.
- Los valores tachados se vuelven en una nueva constante cuyo valor no
nos importa.
- Porque dividiremos la ecuación entre sí
misma, pero para el momento inicial.
- Despejamos el volumen final.
- Y reemplazamos términos. Recuerde que 1 atm
es igual a 760 mmHg, lo cual nos permite reemplazar cancelando analíticamente
las unidades de presión debido a que son iguales y se cancelarían de todas
formas.
Suscríbete a nuestro canal
#cienciasdejoseleg:
https://www.youtube.com/channel/UCoHZZK6xQl_NxIndVdeFgSw?sub_confirmation=1
No olviden consultar
nuestro web “https://quimicadejoseleg-lamateria.blogspot.com/p/la-materia.html”
parte de nuestra serie de blogs de #cienciasdejoseleg, donde encontrarán:
Fundamentos teóricos y
referencias bibliográficas química de gases:
https://quimicadejoseleg-lamateria.blogspot.com/p/quimica-de-gases.html
Mas ejercicios resueltos de
química sobre la química de gases:




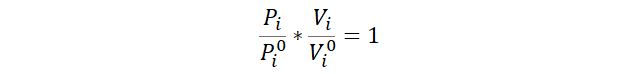
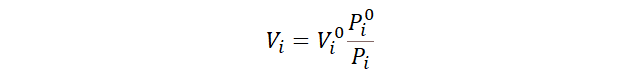

No hay comentarios:
Publicar un comentario