👉Enunciado: Calcule el volumen de O2 (en litros) necesario para la combustión completa de 7.64 L de acetileno (C2H2) medido a la misma temperatura y presión. 2C2H2 (g) + 5O2 (g) → 4CO2 (g) + 2H2O (l).
|| Enlace a YouTube || Mas
ejercicios resueltos || Ejercicios
de otros capítulos de química || Química
de gases || ¡Si te gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2022/01/estequiometria-gases.html
👉Solución: Este es un problema volumen a
volumen, por lo que emplearemos la ley de volúmenes de combinación de
Gay-Lussac.
Reemplazamos
teniendo en cuenta que la sustancia (i) es el oxígeno y la sustancia (d) es el
acetileno y los números estequiométricos: 2C2H2
(g) + 5O2 (g) → 4CO2 (g) + 2H2O (l).
👉Otros
enunciados: Determine el Volumen de O2 que consume completamente 7.64 L de
acetileno, Determinar el Volumen de O2 que consume completamente 7.64 L de
acetileno, Calcule el Volumen de O2 que consume completamente 7.64 L de
acetileno, Calcular el Volumen de O2 que consume completamente 7.64 L de
acetileno, Halle el Volumen de O2 que consume completamente 7.64 L de
acetileno, Hallar el Volumen de O2 que consume completamente 7.64 L de
acetileno,
👉Temas: química, química general, química de gases,
leyes de los gases, ecuación de estado, estequiometría de gases, estequiometría
de gases volumen a volumen, volúmenes de combinación de Gay-Lussac, joseleg



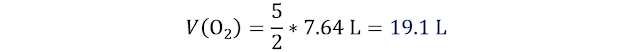
No hay comentarios:
Publicar un comentario