|| Enlace a YouTube || Mas
ejercicios resueltos || Ejercicios
de otros capítulos de química || Química
de gases || ¡Si te gustó, suscríbete! ||
👉 𝑫𝒆𝒎𝒐𝒔𝒕𝒓𝒂𝒄𝒊ó𝒏 𝒅𝒆 𝒍𝒂𝒔 𝒆𝒄𝒖𝒂𝒄𝒊𝒐𝒏𝒆𝒔 𝒄𝒍𝒂𝒗𝒆:
https://quimicadejoseleg-lamateria.blogspot.com/2022/01/estequiometria-gases.html
👉 𝐒𝐨𝐥𝐮𝐜𝐢ó𝐧: Planteamos una ecuación química con
balance indefinido.
Cómo es un problema de radio estequiométrico masa-gas,
emplearemos la siguiente ecuación.
Por ende,
asumiremos que la sustancia 1 es la que está dada en masa (M) y la sustancia 2
la que está dada en gas (H2). Reemplazamos los términos, teniendo en
cuenta que centímetro cúbico es igual a mililitro, que mili es igual a 10-3,
que una atmósfera son 760 mmHg y la masa molar de CaF2 es 78.07 g/mol.
Como no es
un número fácil de convertir a una fracción lo que podemos hacer es sacar su
inverso.
Balanceamos la ecuación química hasta donde es posible.
Como el estado de oxidación del cloro en compuestos binarios con metales
es siempre -1, podemos asegurar con confianza que el Estado de oxidación del
metal es +3, semejante por ejemplo a hierro +3. para la respuesta debemos tener
en cuenta que los óxidos y los sulfatos tienen su estado de oxidación igual a
-2, por lo que sólo tenemos que aplicar la regla de aspa para plantear las
fórmulas M2O3 y M2(SO4)3.
👉 𝑶𝒕𝒓𝒐𝒔 𝒆𝒏𝒖𝒏𝒄𝒊𝒂𝒅𝒐𝒔: Determine el óxido y sulfato de M con 0.225 g M que desplazan 0.303 L 17
°C 741 mmHg H2 en HCl, Determinar el óxido y sulfato de M con 0.225 g M que
desplazan 0.303 L 17 °C 741 mmHg H2 en HCl, Calcule el óxido y sulfato de M con
0.225 g M que desplazan 0.303 L 17 °C 741 mmHg H2 en HCl, Calcular el óxido y
sulfato de M con 0.225 g M que desplazan 0.303 L 17 °C 741 mmHg H2 en HCl, Halle
el óxido y sulfato de M con 0.225 g M que desplazan 0.303 L 17 °C 741 mmHg H2
en HCl, Hallar el óxido y sulfato de M con 0.225 g M que desplazan 0.303 L 17
°C 741 mmHg H2 en HCl,
👉 𝑻𝒆𝒎𝒂𝒔: química,
química general, química de gases, leyes de los gases, ecuación de estado, Estequiometría,
Estequiometría de gases, radio estequiométrico, balanceo de ecuaciones químicas



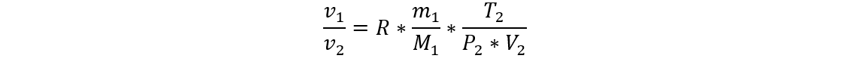



No hay comentarios:
Publicar un comentario