👉Enunciado: Una muestra de 30.0 L de nitrógeno dentro de un contenedor rígido de metal a 20.0 °C se coloca dentro de un horno cuya temperatura es 50.0 °C. La presión dentro del contenedor a 20.0 ° C fue de 6.00 atm. ¿Cuál es la presión del nitrógeno después de aumentar su temperatura a 50.0 °C?
|| Enlace a YouTube || Mas
ejercicios resueltos || Ejercicios
de otros capítulos de química || Química
de gases || ¡Si te gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/la-ley-de-gay-lussac.html
👉Solución: Usamos
la forma dinámica de la ley de Gay-Lussac, despejando la presión final.
Al
reemplazar las temperaturas debemos estar muy pendientes de haberlas
convertido, o de invertirlas in situ a kelvins.
👉Otros
enunciados: Halle la presión final de N2 a 6 atm y 20 °C que pasa a estar a 50 °C,
Hallar la presión final de N2 a 6 atm y 20 °C que pasa a estar a 50 °C,
Determine la presión final de N2 a 6 atm y 20 °C que pasa a estar a 50 °C,
Determinar la presión final de N2 a 6 atm y 20 °C que pasa a estar a 50 °C, Calcule
la presión final de N2 a 6 atm y 20 °C que pasa a estar a 50 °C, Calcular la
presión final de N2 a 6 atm y 20 °C que pasa a estar a 50 °C,
👉Temas: química, química general, química de gases,
leyes de los gases, ecuación de estado, ley de Gay-Lussac, joseleg



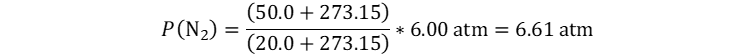
No hay comentarios:
Publicar un comentario