Enunciado: Una muestra de gas natural contiene 8.24 moles de metano (CH4), 0.421 moles de etano (C2H6) y 0.116 moles de propano (C3H8). Si la presión total de los gases es 1.37 atm, ¿cuáles son las presiones parciales de los gases?
Mas ejercicios resueltos de química
sobre #gases. Mas ejercicios resueltos de otros capítulos
de #química. Curso de #quimicadegases. ¡Si
te gustó, suscríbete!
Demostración
de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2021/06/la-ley-de-dalton-de-presiones-parciales.html
Solución:
Iniciamos con la ley de los gases ideales para un soluto cualquiera, y asumimos que la temperatura y el volumen son constantes. Luego dividimos la ecuación entre los mismos términos, pero en sus formas totales. Finalmente, despejamos la presión del soluto cualquiera.
La cantidad de sustancia total es la suma de todos los moles presentes, es decir 8.78 mol.
Para corroborar que el resultado es plausible, la suma de las presiones
parciales debe ser igual a la presión total.
Otros
enunciados: Hallar las presiones parciales
de 8.24 mol CH4 0.421 mol C2H6 0.116 mol C3H8
si P total = 1.37 atm, como hallar la presión parcial con 8.24 0.421 0.116
moles de CH4 C2H6 C3H8,
como hallar la presión parcial con los moles y la presión total, con la presión
total y los moles hallar las presiones parciales,
Temas: química, química general,
química de gases, ley de dalton, ley de las presiones parciales.


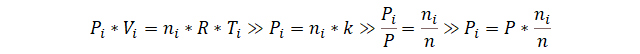

No hay comentarios:
Publicar un comentario