👉Enunciado: La solución acuosa de hidróxido de litio se utiliza para purificar el aire en naves espaciales y submarinos porque absorbe dióxido de carbono, que es un producto final del metabolismo, según la ecuación 2LiOH (aq) + CO2 (g) → Li2CO3 (aq) + H2O (l) La presión del dióxido de carbono dentro de la cabina de un submarino que tiene un volumen de 2.4 x 105 L es 7.9 x 10-3 atm a 312 K. Se introduce en la cabina una solución de hidróxido de litio (LiOH) de volumen insignificante. Finalmente, la presión de CO2 cae a 1.2 x 10-4 atm. ¿Cuántos gramos de carbonato de litio se forman mediante este proceso?
|| Enlace a YouTube || Mas
ejercicios resueltos || Ejercicios
de otros capítulos de química || Química
de gases || ¡Si te gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2022/01/estequiometria-gases.html
👉Solución: dado que el dióxido de carbono no
se consume completamente, este es el reactivo en exceso, y la estequiometría
debe realizarse con el reactivo limitante, que será el hidróxido de litio, por
lo que este es un problema de propiedades de gas a masa. El problema es que el
enunciado no nos da datos para LiOH. Pero dado que conocemos La presión inicial
y final de CO2, podemos calcular la presión que reaccionó de este
asumiendo que las demás condiciones de gas no cambian.
Ahora si
podemos plantear la estequiometría de propiedades de gas a masa. Aunque en la
parte teórica ya dedujimos la fórmula, la recordaremos aquí, pues es tomar la
estequiometría moles a moles, en la incógnita reemplazamos con la masa molar y
a la derecha con las propiedades del gas. También tenga en cuenta que las dos
sustancias involucradas tienen una relación estequiométrica 1:1, lo cual nos
permite cancelar el radio estequiométrico.
La incógnita es (Li2CO3), por lo que calculamos su masa molar.
Reemplazamos en la
solución analítica.
👉Otros enunciados: Determine los
gramos de Li2CO3 formados al purificar el aire de un submarino, Determinar los gramos de Li2CO3 formados al purificar el aire de un
submarino, Calcule los gramos de Li2CO3 formados al
purificar el aire de un submarino, Calcular los gramos de
Li2CO3 formados al purificar el aire de un submarino, Halle los gramos de Li2CO3 formados al purificar el aire de un
submarino, Hallar los gramos de Li2CO3 formados al purificar
el aire de un submarino,
👉Temas: química, química general, química de gases,
leyes de los gases, ecuación de estado, estequiometría de gases, estequiometría
de gases volumen a volumen, volúmenes de combinación de Gay-Lussac, joseleg




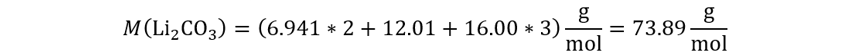
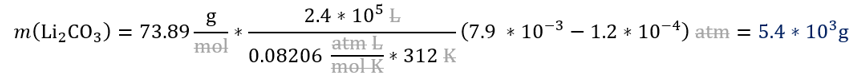
No hay comentarios:
Publicar un comentario