👉Enunciado: Cuando se quema carbón, el azufre presente en el carbón se convierte en dióxido de azufre (SO2), que es responsable del fenómeno de la lluvia ácida. S(s) + O2(g) → SO2(g) Si 2.54 kg de S reaccionan con oxígeno, calcule el volumen de gas SO2 (en mL) formado a 30.5 ° C y 1.12 atm.
|| Enlace a YouTube || Mas
ejercicios resueltos || Ejercicios
de otros capítulos de química || Química
de gases || ¡Si te gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2022/01/estequiometria-gases.html
👉Solución: Usamos la ley de radio
estequiométrico, con la incógnita expresada en términos de variable de gas, y
despejamos el volumen del gas, mientras que el dato se expresa en términos de
masa y masa molar. Tenga en cuenta que como los números estequiométricos de las
dos sustancias clave son iguales, podemos cancelar el radio estequiométrico.
El dato es
el azufre elemental monoatómico, por lo que su masa molar es su peso atómico en
unidades correspondientes 32.07 g/mol. Reemplazamos.
👉Otros enunciados: Determine el volumen de SO2 producido a 30.5 °C y 1.12 atm a partir de
2.54 g de S, Determinar el volumen de SO2
producido a 30.5 °C y 1.12 atm a partir de 2.54 g de S, Calcule el volumen de SO2 producido a 30.5 °C y 1.12 atm a partir de
2.54 g de S, Calcular el volumen de SO2
producido a 30.5 °C y 1.12 atm a partir de 2.54 g de S, Halle el volumen de SO2 producido a 30.5 °C y 1.12 atm a partir de 2.54
g de S, Hallar el volumen de SO2 producido a 30.5 °C y
1.12 atm a partir de 2.54 g de S,
👉Temas: química, química general, química de gases,
leyes de los gases, ecuación de estado, estequiometría de gases, joseleg



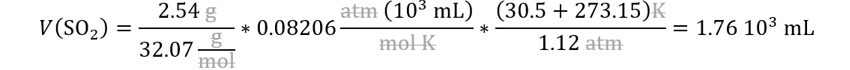
No hay comentarios:
Publicar un comentario