👉Enunciado: En la fermentación del alcohol, la levadura convierte la glucosa en etanol y dióxido de carbono: C6H12O6(s) → 2C2H5OH (l) + 2CO2(g). Si se hacen reaccionar 5.97 g de glucosa y se recogen 1.44 L de gas CO2 a 293 K y 0.984 atm, ¿Cuál es el porcentaje de rendimiento de la reacción?
|| Enlace a YouTube || Mas
ejercicios resueltos || Ejercicios
de otros capítulos de química || Química
de gases || ¡Si te gustó, suscríbete! ||
👉Demostración
de las ecuaciones clave:
https://quimicadejoseleg-lamateria.blogspot.com/2022/01/estequiometria-gases.html
👉Solución: Tomamos la función que relaciona la eficiencia con un producto clave medido experimentalmente y un reactivo clave y expresamos el producto en términos de variable de gas, y al reactivo en masa y masa molar.
Calculamos
la masa molar del reactivo clave,
Reemplazamos.
👉Otros enunciados: Determine el % de rendimiento de 1.44 L de CO2 a 293 K y 0.984 atm producidos por 5.97 g C6H12O6, Determinar el % de rendimiento de 1.44 L de CO2 a 293 K y 0.984 atm producidos
por 5.97 g C6H12O6, Calcule el % de rendimiento de 1.44 L de CO2 a 293 K y 0.984 atm producidos por 5.97 g C6H12O6, Calcular el % de rendimiento de 1.44 L de CO2 a 293 K y 0.984 atm producidos por 5.97 g C6H12O6, Halle el % de rendimiento de 1.44 L de CO2 a 293 K y 0.984 atm producidos por 5.97 g C6H12O6, Hallar el % de rendimiento de 1.44 L de CO2 a 293 K y 0.984 atm producidos por 5.97 g C6H12O6,
👉Temas: química, química general, química de gases,
leyes de los gases, ecuación de estado, estequiometría de gases, joseleg




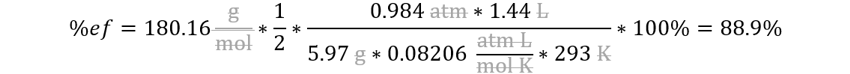
No hay comentarios:
Publicar un comentario